Aditivos para a alimentação animal: Autorizações e reautorizações de novembro/dezembro de 2024 e utilizações previstas
- Feed additives
- Feed safety
Resumo
Uma panorâmica das últimas autorizações e reautorizações de aditivos para a alimentação animal e actualizações da lista de utilizações previstas na alimentação animal para animais-alvo.
A UE autoriza ou volta a autorizar determinados aditivos para a alimentação animal e actualiza a lista de utilizações previstas - novembro/dezembro de 2024
Regulamentos de execução da Comissão 2024/2899, 2024/3162, 2024/3166, 2024/3167, 2024/3168
Atualização
Uma panorâmica das últimas autorizações e reautorizações de aditivos para a alimentação animal e actualizações da lista de utilizações previstas na alimentação animal para animais-alvo.
Produtos afetados
Aditivos para alimentação animal
o que está a mudar?
Autorizações e reautorizações
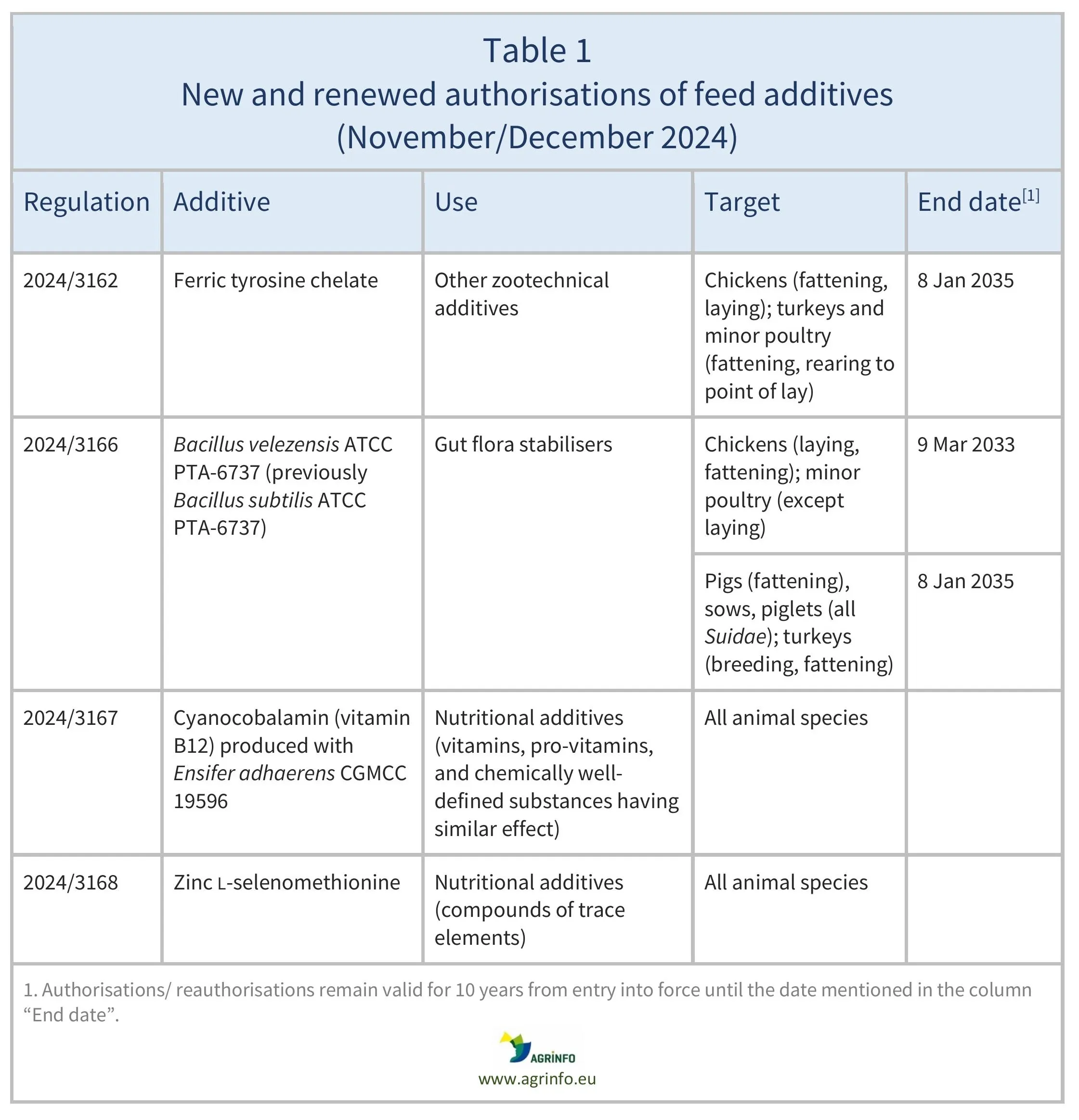
Em novembro e dezembro de 2024, a UE autorizou e reautorizou os aditivos para a alimentação animal enumerados no quadro 1. Estas autorizações e reautorizações baseiam-se em pareceres publicados pela Autoridade Europeia para a Segurança dos Alimentos (EFSA 2019, 2023a, 2023b, 2024a, 2024b). As condições de utilização estão descritas nos respetivos regulamentos.
Actualizações da lista de utilizações pretendidas
A utilização de 1,25-di-hidroxicolecalciferol glicosilado do extrato de Solanum glaucophyllum para reduzir o risco de febre do leite e hipocalcemia subclínica (níveis baixos de cálcio) em vacas está agora incluída na lista de utilizações previstas dos alimentos para animais com objectivos nutricionais específicos (Regulamento 2024/2899).
porquê?
Os pedidos relativos a estas autorizações e reautorizações foram analisados pelo Laboratório de Referência criado pelo Regulamento relativo aos aditivos para a alimentação animal(1831/2003).
A EFSA (2022) concluiu que o 1,25-di-hidroxicolecalciferol glicosilado do extrato de S. glaucophyllum, administrado por via oral num alimento complementar desde 9 dias antes do parto até imediatamente antes do parto, tem potencial para prevenir a hipocalcemia em vacas leiteiras.
Cronologia
As autorizações e reautorizações permanecem válidas até às datas-limite indicadas no quadro 1.
quais são as principais implicações para os países exportadores?
Com estas autorizações, estarão disponíveis no mercado mais aditivos para a alimentação animal. As autorizações e as renovações são válidas por 10 anos. Todos os aditivos para a alimentação animal devem ser utilizados tal como especificado no anexo de cada regulamento.
Acções recomendadas
Recomenda-se aos países terceiros que produzem aditivos para a alimentação animal, alimentos compostos para animais e matérias-primas para a alimentação animal destinados à exportação para a UE que verifiquem a sua situação no registo de aditivos para a alimentação animal da UE.
Para poder filtrar e ver mais informações, pode descarregar o registo em formato Excel (ver a página Web do Portal de Informação sobre Alimentos para Consumo Humano e Animal > Aditivos para alimentação animal > Descarregar o registo em formato Excel).
Contexto legal
O procedimento para autorizar a colocação no mercado e a utilização de aditivos para a alimentação animal está definido no Regulamento (CE) n. º 1831/2003. Para obter as últimas actualizações sobre os aditivos para a alimentação animal, consulte o registo de aditivos para a alimentação animal da UE.
Recursos
Comissão Europeia: Base de dados do portal de informação sobre géneros alimentícios e alimentos para animais: Aditivos para a alimentação animal
Regulamento (CE) n. º 1831/2003 relativo aos aditivos destinados à alimentação animal
EFSA (2023a) Alteração dos termos da autorização de L-selenometionina de zinco como aditivo em alimentos para animais de todas as espécies (Zinpro Animal Nutrition (Europe), Inc.). EFSA Journal, 21: e8459
EFSA (2022) Safety and efficacy of a feed additive consisting of Solanum glaucophyllum leaf extract for dairy cows and other dairy ruminants (Herbonis Animal Health Gmbh) [Segurança e eficácia de um aditivo para a alimentação animal constituído por extrato de folhas de Solanum glaucophyllum para vacas leiteiras e outros ruminantes leiteiros]. EFSA Journal, 20(8): 7434.
EFSA (2019) Safety and efficacy of TYFER™ (ferric tyrosine chelate) as a zootechnical feed additive for chickens, turkeys and minor poultry species for fattening or reared for laying/breeding. EFSA Journal, 17(2): 5608.
Fontes
Regulamento de execução da Comissão:
2024/2899 que estabelece uma lista das utilizações previstas para os alimentos destinados a objectivos nutricionais específicos
2024/3162 relativo à autorização do quelato férrico de tirosina como aditivo em alimentos para todas as espécies de aves de capoeira de engorda, todas as espécies de aves de capoeira criadas para postura e perus e espécies menores de aves de capoeira criadas para reprodução (detentor da autorização: Akeso Biomedical, Inc. EUA, representada na União por Pen & Tec Consulting SLU)
2024/3166 relativo à renovação da autorização de uma preparação de Bacillus velezensis ATCC PTA-6737 como aditivo em alimentos para perus de engorda, perus criados para reprodução, leitões desmamados, Suidae desmamados, exceto Sus scrofa domesticus, e porcas, a sua autorização para suínos de engorda de todas as espécies de Suidae, leitões de todas as espécies de Suidae e porcas de espécies menores de Suidae (detentor da autorização: Kemin Europa N.V.)
2024/3167 relativo à autorização de cianocobalamina (vitamina B12) produzida com Ensifer adhaerens CGMCC 19596 como aditivo em alimentos para animais de todas as espécies
2024/3168 relativo à autorização de uma preparação de zinco-L-selenometionina como aditivo em alimentos para animais de todas as espécies
Isenção de responsabilidade: Em nenhuma circunstância a COLEAD será responsável por quaisquer perdas, danos, responsabilidades ou despesas incorridas ou sofridas que sejam alegadamente resultantes da utilização das informações disponíveis neste sítio Web ou de qualquer ligação a sítios externos. A utilização do sítio Web é da exclusiva responsabilidade e risco do utilizador. Esta plataforma de informação foi criada e é mantida com o apoio financeiro da União Europeia. No entanto, o seu conteúdo não reflete as opiniões da União Europeia.
A UE autoriza ou volta a autorizar determinados aditivos para a alimentação animal e actualiza a lista de utilizações previstas - novembro/dezembro de 2024
Commission Implementing Regulations 2024/2899, 2024/3162, 2024/3166, 2024/3167, 2024/3168
o que está a mudar e porquê?
Em novembro e dezembro de 2024, a UE autorizou ou voltou a autorizar os aditivos para a alimentação animal enumerados no quadro 1. Estas decisões baseiam-se em pareceres publicados pela Autoridade Europeia para a Segurança dos Alimentos (EFSA). Todos os aditivos para a alimentação animal devem ser utilizados conforme especificado no anexo de cada regulamento.
A utilização do extrato de Solanum glaucophyllum para reduzir o risco de febre vitular e hipocalcemia subclínica (níveis baixos de cálcio) em vacas antes do parto foi validada pela AESA e está agora incluída na lista de utilizações previstas dos alimentos para animais com objectivos nutricionais específicos.
Acções
Recomenda-se aos países terceiros que produzem aditivos para a alimentação animal, alimentos compostos para animais e matérias-primas para a alimentação animal destinados à exportação para a UE que verifiquem a sua situação no registo de aditivos para a alimentação animal da UE.
Para poder filtrar e ver mais informações, pode descarregar o registo em formato Excel (ver a página Web do Portal de Informação sobre Alimentos para Consumo Humano e Animal > Aditivos para alimentação animal > Descarregar o registo em formato Excel).
Cronologia
As autorizações e reautorizações permanecem válidas até às datas-limite indicadas no quadro 1.
Quadros e figuras
Isenção de responsabilidade: Em nenhuma circunstância a COLEAD será responsável por quaisquer perdas, danos, responsabilidades ou despesas incorridas ou sofridas que sejam alegadamente resultantes da utilização das informações disponíveis neste sítio Web ou de qualquer ligação a sítios externos. A utilização do sítio Web é da exclusiva responsabilidade e risco do utilizador. Esta plataforma de informação foi criada e é mantida com o apoio financeiro da União Europeia. No entanto, o seu conteúdo não reflete as opiniões da União Europeia.