Additifs pour l'alimentation animale : Autorisations et réautorisations pour septembre 2024
- Feed additives
Résumé
Une vue d'ensemble des dernières autorisations et réautorisations d'additifs pour l'alimentation animale et de leur utilisation dans l'alimentation des animaux cibles.
L'UE autorise et réautorise certains additifs pour l'alimentation animale
Règlements d'application de la Commission 2024/2177, 2024/2180, 2024/2184, 2024/2185, 2024/2385, 2024/2388, 2024/2389, 2024/2393, 2024/2412, 2024/2414, 2024/2427, 2024/2441, 2024/2464
Mise à jour
Une vue d'ensemble des dernières autorisations et réautorisations d'additifs pour l'alimentation animale et de leur utilisation dans l'alimentation des animaux cibles.
Produits concernés
Additifs pour l'alimentation animale, fourrages préparés
qu'est-ce qui change ?
Autorisations
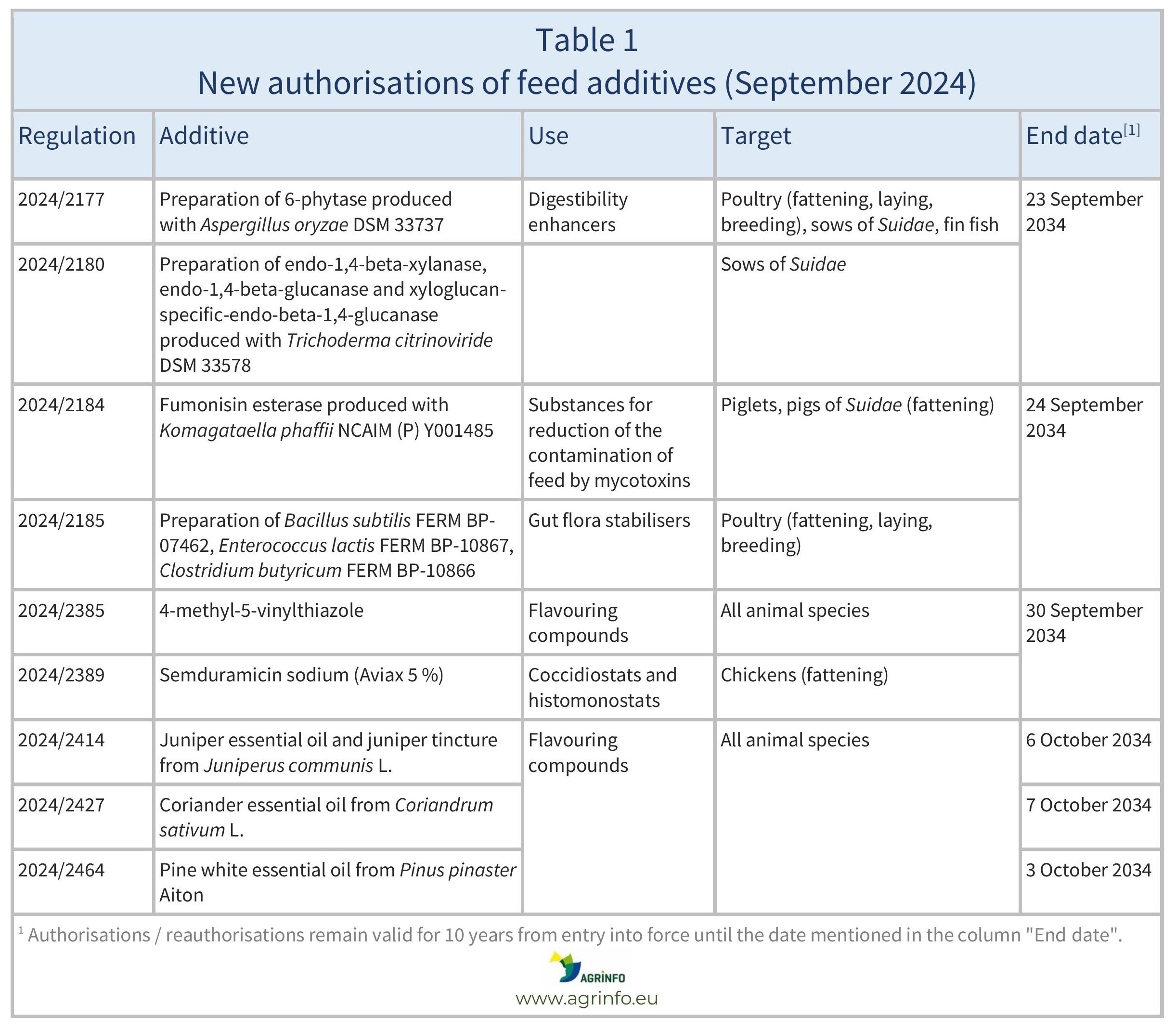
En septembre 2024, l'UE a autorisé les additifs pour l'alimentation animale énumérés dans le tableau 1.
Ces autorisations sont basées sur les avis publiés par l'Autorité européenne de sécurité des aliments (EFSA). Les conditions d'utilisation sont décrites dans les règlements respectifs.
Réautorisations
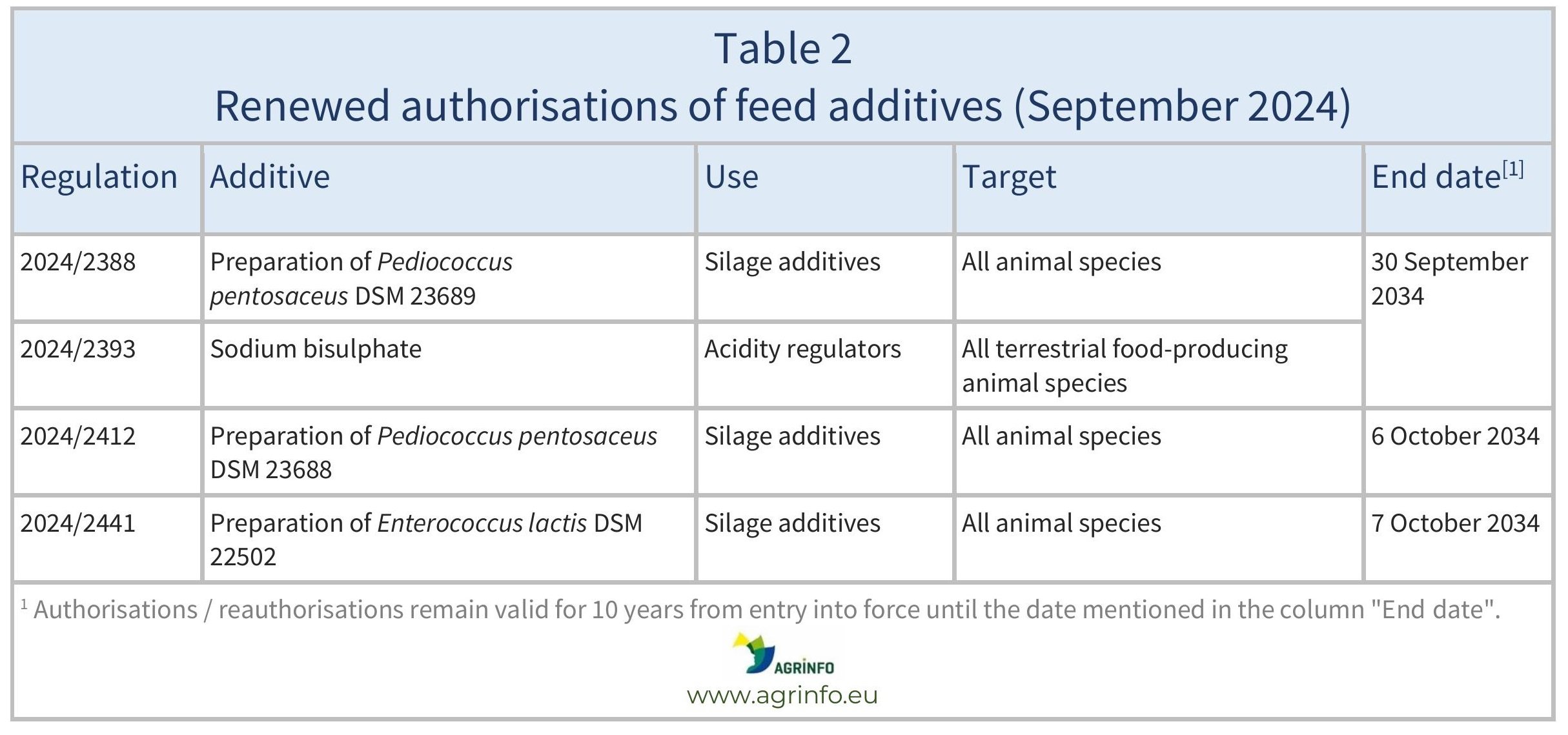
En septembre 2024, l'UE a réautorisé les additifs pour l'alimentation animale énumérés dans le tableau 2.
Ces autorisations sont basées sur les avis publiés par l'Autorité européenne de sécurité des aliments (EFSA). Les conditions d'utilisation sont décrites dans les règlements respectifs.
pourquoi ?
Les demandes d'autorisation et de renouvellement d'autorisation susmentionnées ont été soumises et examinées par le laboratoire de référence institué par le règlement sur les additifs pour l'alimentation animale(1831/2003).
Calendrier
Les autorisations et les réautorisations restent valables jusqu'aux dates d'expiration indiquées dans les tableaux 1 et 2.
quelles sont les principales implications pour les pays exportateurs ?
Grâce à ces autorisations, davantage d'additifs pour l'alimentation animale seront disponibles sur le marché. Les autorisations et les renouvellements sont valables 10 ans. L'utilisation de toutes les préparations et substances spécifiées en tant qu'additifs pour l'alimentation animale doit être conforme aux dispositions d'utilisation spécifiées dans l'annexe de chaque règlement.
Actions recommandées
Il est recommandé aux pays non membres de l'UE qui produisent des additifs pour l'alimentation animale, des aliments composés pour animaux et des matières premières pour l'alimentation animale destinés à être exportés vers l'UE de vérifier le statut des additifs pour l'alimentation animale dans le registre des additifs pour l'alimentation animale de l'UE.
Pour pouvoir filtrer et voir plus d'informations, il est conseillé de télécharger le registre au format Excel (voir la page web du portail d'information sur les denrées alimentaires et les aliments pour animaux).
Contexte
La procédure d'autorisation de mise sur le marché et d'utilisation des additifs pour l'alimentation animale est définie dans le règlement (CE) 1831/2003. Pour obtenir les dernières mises à jour sur les additifs pour l'alimentation animale, consultez le registre des additifs pour l'alimentation animale de l'UE.
Ressources
Registreeuropéen desadditifs pour l'alimentation animale
Règlement (CE) n° 1831/2003 relatif aux additifs destinés à l'alimentation des animaux
- EFSA (2022) Sécurité et efficacité d'un additif alimentaire composé de Bacillus subtilis FERM BP-07462, Enterococcus lactis FERM BP-10867 et Clostridium butyricum FERM BP-10866 (BIO-THREE®) pour les poulets d'engraissement, les poulets élevés pour la ponte, les dindes d'engraissement, les dindes élevées pour la reproduction, toutes les espèces aviaires pour l'élevage/l'engraissement jusqu'à l'abattage et toutes les espèces aviaires élevées pour la ponte ou la reproduction jusqu'au point de ponte (TOA BIOPHARMA Co., Ltd.). EFSA Journal, 20(6) : 7342.
- EFSA (2022) Safety of a feed additive consisting of semduramicin sodium (Aviax 5%) for chickens for fattening (Phibro Animal Health s.a.) (Sécurité d'un additif alimentaire composé de semduramicine sodique (Aviax 5%) pour les poulets d'engraissement (Phibro Animal Health s.a.). EFSA Journal, 20(8) : 7432.
- EFSA (2023) Safety and efficacy of a feed additive consisting of an essential oil obtained from the oleoresin of Pinus pinaster Aiton (pine white oil) for use in all animal species (FEFANA asbl) (Sécurité et efficacité d'un additif alimentaire composé d'une huile essentielle obtenue à partir de l'oléorésine de Pinus pinaster Aiton (huile blanche de pin) pour toutes les espèces animales). Journal de l'EFSA, 21(2) : 7952.
- EFSA (2022) Sécurité et efficacité des additifs alimentaires composés d'une huile essentielle et d'une teinture de baies de Juniperus communis L. (huile de genièvre et teinture de genièvre) destinés à toutes les espèces animales (FEFANA asbl). Journal de l'EFSA, 21(4) : 7977.
- EFSA (2022) Sécurité et efficacité de l'additif pour l'alimentation animale 4-méthyl-5-vinylthiazole [15.018] appartenant au groupe chimique 29 pour toutes les espèces animales (FEFANA asbl). EFSA Journal, 21(6) : 8051.
- EFSA (2022) Sécurité et efficacité d'un additif pour l'alimentation animale consistant en une huile essentielle obtenue à partir du fruit de Coriandrum sativum L. (huile de coriandre) (FEFANA asbl). Journal de l'EFSA, 21(10) : 8349.
- EFSA (2023) Efficacité d'un additif alimentaire composé de Bacillus subtilis FERM BP-07462, Enterococcus lactis FERM BP-10867 et Clostridium butyricum FERM BP-10866 (BIO-THREE®) pour les poulets d'engraissement et de ponte, les dindes d'engraissement et de reproduction et toutes les espèces aviaires d'élevage/d'engraissement ou de ponte/de reproduction (TOA BIOPHARMA Co, Ltd.). EFSA Journal, 21(11) : 8343.
- EFSA (2024) Évaluation de l'additif alimentaire composé de Pediococcus pentosaceus DSM 23688 pour toutes les espèces animales en vue du renouvellement de son autorisation (Chr. Hansen A/S). EFSA Journal, 22(2) : e8619.
- EFSA (2024) Évaluation de l'additif alimentaire composé de Pediococcus pentosaceus DSM 23689 pour toutes les espèces animales en vue du renouvellement de son autorisation (Chr. Hansen A/S). EFSA Journal, 22(2) : e8620.
- EFSA (2024) Sécurité et efficacité d'un additif alimentaire composé de fumonisine estérase produite par Komagataella phaffii NCAIM (P) Y001485 pour tous les porcs (porcelets, porcs d'engraissement, truies et autres espèces porcines mineures en croissance et en reproduction) (Dr. Bata Ltd.). EFSA Journal, 22(3) : e8614.
- EFSA (2024) Évaluation de l'additif alimentaire composé d'Enterococcus lactis DSM 22502 pour toutes les espèces animales en vue du renouvellement de son autorisation (Chr. Hansen A/S). EFSA Journal, 22(3) : e8621.
- EFSA (2024) Sécurité et efficacité d'un additif alimentaire composé d'endo-1,4-β xylanase, d'endo-1,4-β-glucanase et d'endo-β-1,4-glucanase spécifique du xyloglucane produit par Trichoderma citrinoviride DSM 33578 (Huvezym® neXo) pour tous les Suidae (Huvepharma EOOD). EFSA Journal, 22(3) : e8643.
- EFSA (2024) Sécurité et efficacité d'un additif alimentaire composé de bisulfate de sodium pour toutes les espèces animales à l'exception des animaux aquatiques (Grillo Werke AG & Jones-Hamilton Co.). EFSA Journal, 22(3) : e8644.
- EFSA (2024) Sécurité et efficacité d'un additif alimentaire composé de 6-phytase produite par Aspergillus oryzae DSM 33737 (HiPhorius™) pour toutes les volailles, tous les suidés et tous les poissons à nageoires (DSM Nutritional Products Ltd). Journal de l'EFSA, 22(3) : e8663.
Sources
Règlements d'application de la Commission :
- 2024/2464 concernant l'autorisation de l'huile essentielle de pin blanc de Pinus pinaster Aiton en tant qu'additif pour l'alimentation de toutes les espèces animales
- 2024/2441 concernant le renouvellement de l'autorisation d'une préparation d'Enterococcus lactis DSM 22502 en tant qu'additif pour l'alimentation de toutes les espèces animales et abrogeant le règlement d'exécution (UE) n° 304/2014
- 2024/2427 concernant l'autorisation de l'huile essentielle de coriandre de Coriandrum sativum L. en tant qu'additif pour l'alimentation de toutes les espèces animales
- 2024/2414 concernant l'autorisation de l'huile essentielle de genièvre et de la teinture de genièvre de Juniperus communis L. en tant qu'additifs pour l'alimentation de toutes les espèces animales
- 2024/2412 concernant le renouvellement de l'autorisation d'une préparation de Pediococcus pentosaceus DSM 23688 en tant qu'additif pour l'alimentation de toutes les espèces animales et modifiant le règlement d'exécution (UE) n° 84/2014
- 2024/2393 concernant le renouvellement de l'autorisation du bisulfate de sodium et l'autorisation de nouvelles utilisations de cette substance en tant qu'additif pour l'alimentation de certaines espèces animales
- 2024/2389 concernant l'autorisation d'une préparation de semduramicine sodique (Aviax 5 %) en tant qu'additif alimentaire pour les poulets d'engraissement (titulaire de l'autorisation : Phibro Animal Health s.a.) et abrogeant le règlement (CE) no 1443/2006
- 2024/2388 concernant le renouvellement de l'autorisation d'une préparation de Pediococcus pentosaceus DSM 23689 en tant qu'additif pour l'alimentation de toutes les espèces animales et modifiant le règlement d'exécution (UE) n° 84/2014
- 2024/2385 concernant l'autorisation du 4-méthyl-5-vinylthiazole en tant qu'additif pour l'alimentation de toutes les espèces animales
- 2024/2185 du 3 septembre 2024 concernant l'autorisation d'une préparation de Bacillus subtilis FERM BP-07462, Enterococcus lactis FERM BP-10867 et Clostridium butyricum FERM BP-10866 en tant qu'additif alimentaire pour toutes les espèces de volailles d'engraissement, toutes les espèces de volailles élevées pour la ponte ou la reproduction et les oiseaux d'ornement (titulaire de l'autorisation : Toa Biopharma Co., Ltd.)
- 2024/2184 concernant l'autorisation d'une préparation de fumonisine estérase produite avec Komagataella phaffii NCAIM (P) Y001485 en tant qu'additif alimentaire pour les porcelets et les porcs d'engraissement de toutes les espèces de Suidae
- 2024/2180 concernant l'autorisation d'une préparation d'endo-1,4-bêta-xylanase, d'endo-1,4-bêta-glucanase et d'endo-bêta-1,4-glucanase spécifique du xyloglucane produite par Trichoderma citrinoviride DSM 33578 en tant qu'additif alimentaire pour les truies de toutes les espèces de Suidae (titulaire de l'autorisation : Huvepharma EOOD)
- 2024/2177 concernant l'autorisation d'une préparation de 6-phytase produite avec Aspergillus oryzae DSM 33737 en tant qu'additif alimentaire pour toutes les espèces de volailles d'engraissement ou élevées pour la ponte ou élevées pour la reproduction, pour les truies de toutes les espèces de Suidae et pour tous les poissons à nageoires (titulaire de l'autorisation : DSM Nutritional Products Ltd, représentée par DSM Nutritional Products Sp. z o.o.)
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.
L'UE autorise et réautorise certains additifs pour l'alimentation animale
Commission Implementing Regulations 2024/2177, 2024/2180, 2024/2184, 2024/2185, 2024/2385, 2024/2388, 2024/2389, 2024/2393, 2024/2412, 2024/2414, 2024/2427, 2024/2441, 2024/2464
qu'est-ce qui change et pourquoi ?
Autorisations et réautorisations
En septembre 2024, l'UE a autorisé ou réautorisé les additifs pour l'alimentation animale énumérés dans les tableaux 1 et 2. Ces autorisations sont basées sur les avis publiés par l'Autorité européenne de sécurité des aliments (EFSA). Les conditions d'utilisation sont décrites dans les règlements respectifs.
Calendrier
Les autorisations et les réautorisations restent valables jusqu'aux dates d'expiration indiquées dans les tableaux 1 et 2.
Tableaux et figures
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.