Nouvel aliment : oléorésine d'algues riche en astaxanthine
- Food safety
- Novel/traditional foods
- Food information
- Labelling
Résumé
La Commission européenne a approuvé une modification des spécifications du nouvel aliment, l'oléorésine riche en astaxanthine provenant de l'algue Haematococcus pluvialis.
L'UE approuve la modification des spécifications de l'oléorésine riche en astaxanthine issue de l'algue Haematococcus pluvialis
Règlement d'exécution (UE) 2024/1026 de la Commission du 8 avril 2024 modifiant le règlement d'exécution (UE) 2017/2470 en ce qui concerne les spécifications du nouvel aliment, l'oléorésine riche en astaxanthine issue de l'algue Haematococcus pluvialis
Mise à jour
La Commission européenne a approuvé une modification des spécifications du nouvel aliment, l'oléorésine riche en astaxanthine provenant de l'algue Haematococcus pluvialis.
qu'est-ce qui change ?
Le présent règlement autorise l'abaissement des limites minimales de spécification pour les protéines et les monoesters d'astaxanthine (ATX), ainsi que l'augmentation des limites maximales de spécification pour les quantités relatives de diesters d'ATX et de stéréoisomères 9-cis dans l'ATX total (voir tableau 1).
pourquoi ?
L'EFSA(2023) a conclu que les modifications proposées dans les spécifications sont sûres à la dose journalière admissible (DJA) d'ATX provenant de compléments alimentaires à 0,2 mg/kg de poids corporel.
Calendrier
Les nouvelles spécifications s'appliquent à partir du 29 avril 2024.
Actions recommandées
Les exportateurs de compléments alimentaires contenant cette substance doivent s'assurer que les nouvelles spécifications énoncées dans le tableau 1 sont respectées.
Contexte
L'astaxanthine est un caroténoïde produit à partir de l'algue H. pluvialis, dont l'utilisation dans les compléments alimentaires destinés à la population générale a été autorisée pour la première fois par le règlement (UE) 2017/2470.
Le règlement d'exécution 2021/1377 a limité ses conditions d'utilisation aux adultes et aux adolescents de plus de 14 ans sur la base d'un avis de l'EFSA (2020).
Le règlement d'exécution (UE) 2023/1581 a autorisé son utilisation dans les compléments alimentaires destinés aux enfants de 3 à 10 ans et aux adolescents de 10 à 14 ans, à condition que l'apport d'ATX par les compléments alimentaires ne dépasse pas une DJA de 0,2 mg/kg de poids corporel par jour.
Pour plus d'informations sur la procédure d'autorisation des nouveaux aliments, voir Les nouveaux aliments expliqués.
Ressources
EFSA (2023) Safety of a change in specifications of the novel food oleoresin from Haematococcus pluvialis containing astaxanthin pursuant to Regulation (EU) 2015/2283. Journal de l'EFSA, 21(11) : 5993.
EFSA (2020) Safety of astaxanthin for its use as a novel food in food supplements (Sécurité de l'astaxanthine pour son utilisation en tant que nouvel aliment dans les compléments alimentaires). EFSA Journal, 18(2) : 8338.
Règlement d'exécution (UE) 2017/2470 établissant la liste des nouveaux aliments
Règlement d'exécution (UE) 2021/1377 autorisant la modification des conditions d'utilisation du nouvel aliment, l'oléorésine riche en astaxanthine de l'algue Haematococcus pluvialis
Règlement d'exécution (UE) 2023/1581 en ce qui concerne les conditions d'utilisation du nouvel aliment "oléorésine riche en astaxanthine provenant de l'algue Haematococcus pluv ialis"
Sources
Mise en œuvre du règlement (UE) n° 2024/1026 en ce qui concerne les spécifications du nouvel aliment, l'oléorésine riche en astaxanthine provenant de l'algue Haematococcus pluvialis
Tableaux et figures
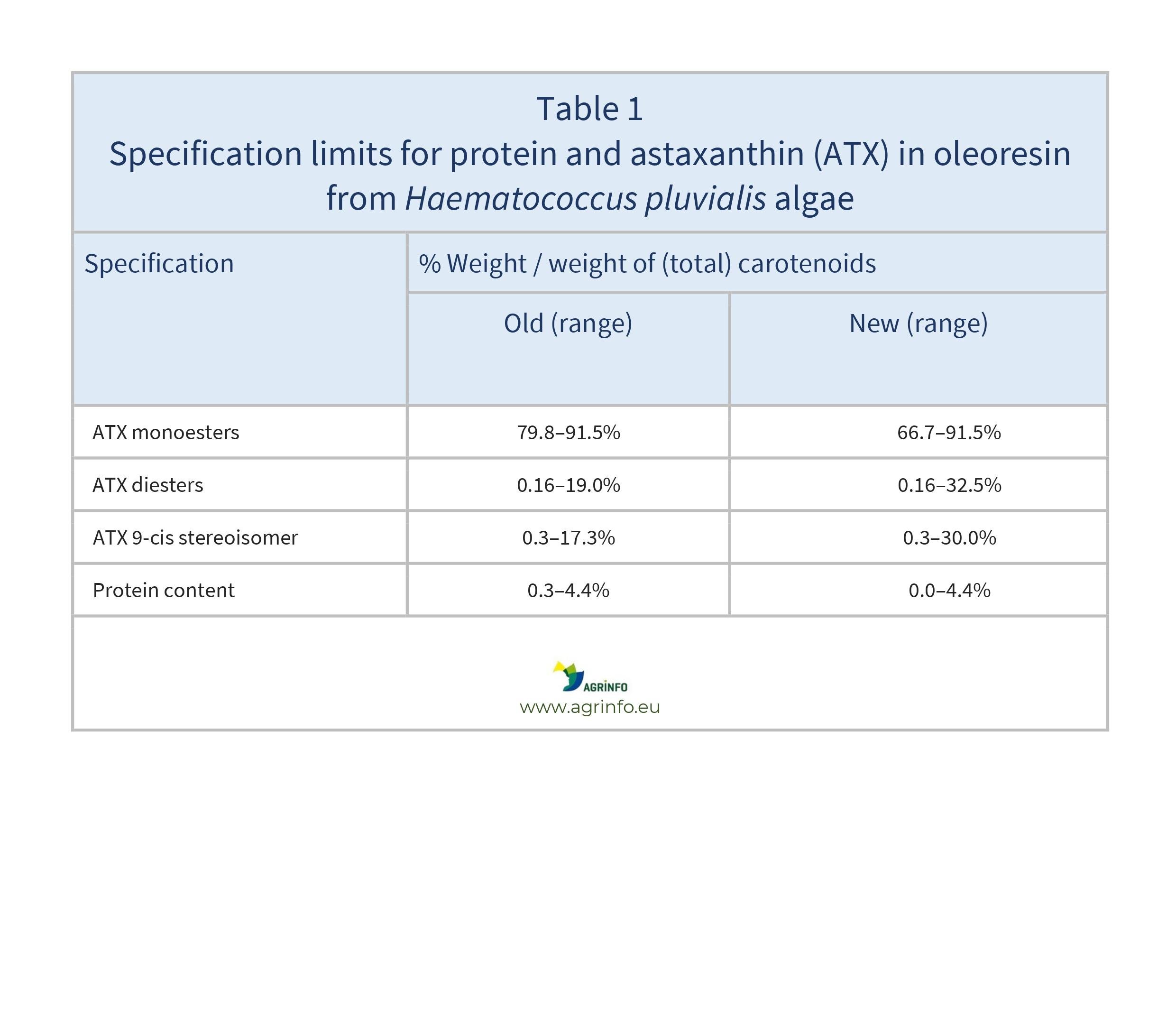
Source: Implementing Regulation (EU) 2024/1026
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.
L'UE approuve la modification des spécifications de l'oléorésine riche en astaxanthine issue de l'algue Haematococcus pluvialis
Regulation 2024/1026 as regards the specifications of the novel food astaxanthin-rich oleoresin from Haematococcus pluvialis algae
qu'est-ce qui change et pourquoi ?
La Commission européenne a approuvé une modification des spécifications du nouvel aliment, l'oléorésine riche en astaxanthine provenant de l'algue Haematococcus pluvialis. Les compléments alimentaires contenant de l'astaxanthine (ATX), un caroténoïde, sont autorisés pour les adultes, les enfants de 3 à 10 ans et les adolescents de 10 à 14 ans. L'Autorité européenne de sécurité des aliments (EFSA) a conclu que son utilisation est sûre tant que la consommation d'ATX ne dépasse pas la dose journalière admissible (DJA) de 0,2 mg/kg de poids corporel par jour. Ce règlement autorise des limites minimales inférieures pour les protéines et les monoesters d'ATX, et des limites maximales plus élevées pour les diesters d'ATX et le stéréo-isomère 9-cis dans l'ATX total (voir tableau 1).
Actions
Les exportateurs de compléments alimentaires contenant cette substance doivent s'assurer que les nouvelles spécifications énoncées dans le tableau 1 sont respectées.
Calendrier
Les nouvelles spécifications s'appliquent à partir du 29 avril 2024.
Tableaux et figures

Source: Implementing Regulation (EU) 2024/1026
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.
