Nouvel aliment : Clostridium butyricum TO-A
- Food safety
- Novel/traditional foods
Résumé
L'Union européenne (UE) a autorisé l'utilisation du nouvel aliment Clostridium butyricum TO-A dans les compléments alimentaires destinés à la population générale âgée de plus de 3 ans, à l'exclusion des femmes enceintes et allaitantes, lorsque des niveaux maximaux spécifiques ne sont pas dépassés.
L'UE autorise l'utilisation du nouvel aliment Clostridium butyricum TO-A
Règlement d'exécution (UE) 2025/2233 de la Commission du 6 novembre 2025 autorisant la mise sur le marché de Clostridium butyricum TO-A en tant que nouvel aliment et modifiant le règlement d'exécution (UE) 2017/2470.
Mise à jour
L'Union européenne (UE) a autorisé l'utilisation du nouvel aliment Clostridium butyricum TO-A dans les compléments alimentaires destinés à la population générale âgée de plus de 3 ans, à l'exclusion des femmes enceintes et allaitantes, lorsque des niveaux maximaux spécifiques ne sont pas dépassés.
qu'est-ce qui change ?
L'UE a autorisé l'utilisation de Clostridium butyricum TO-A en tant que nouvel aliment dans les compléments alimentaires destinés à la population générale âgée de plus de 3 ans, à l'exclusion des femmes enceintes et allaitantes.
Les compléments alimentaires contenant du C. butyricum TO-A ne doivent pas dépasser les teneurs maximales spécifiées pour chaque groupe d'âge (voir tableau 1).
L'étiquetage des compléments alimentaires contenant du C. butyricum TO-A doit comporter les mentions suivantes
- "Clostridium butyricum TO-A"
- une mention des groupes d'âge qui ne doivent pas consommer ces compléments, en fonction des consommateurs visés :
- les femmes enceintes et allaitantes
- les nourrissons et les enfants de moins de 3, 10 ou 14 ans
- les nourrissons, les enfants et les adolescents de moins de 18 ans.
Seule l'entreprise qui a demandé l'autorisation, TOA Biopharma Co. Ltd, est autorisée à vendre ce nouvel aliment sur le marché de l'UE au cours des cinq prochaines années, à moins qu'elle n'autorise la commercialisation par d'autres entreprises ou qu'une autre entreprise obtienne une autorisation de nouvel aliment sans faire référence aux données scientifiques protégées par TOA Biopharma Co. Ltd.
pourquoi ?
L'Autorité européenne de sécurité des aliments(EFSA 2025) a conclu que le nouvel aliment Clostridium butyricum TO-A est sûr lorsqu'il est utilisé dans des compléments alimentaires destinés à la population générale âgée de plus de 3 ans, à l'exclusion des femmes enceintes et allaitantes, lorsqu'il ne dépasse pas des niveaux maximaux spécifiques.
Calendrier
Ce nouvel aliment pourra être mis sur le marché de l'UE à partir du 27 novembre 2025.
Contexte
Clostridium butyricum TO-A est une bactérie de la souche TO-A, déposée sous le numéro FERM BP-10866.
Ce règlement met à jour l'annexe du règlement 2017/2470 qui dresse la liste des nouveaux aliments autorisés (voir la liste des nouveaux aliments de l'Union). Pour plus d'informations sur le processus d'autorisation des nouveaux aliments de l'Union, voir Les nouveaux aliments expliqués.
Ressources
EFSA (2025) Sécurité de Clostridium butyricum TO-A en tant que nouvel aliment conformément au règlement (UE) 2015/2283. EFSA Journal, 23 : e9371.
Règlement 2017/2470 établissant la liste de l'Union des nouveaux aliments.
Règlement 2015/2283 relatif aux nouveaux aliments.
Sources
Règlement d'exécution (UE) 2025/2233 de la Commission autorisant la mise sur le marché de Clostridium butyricum TO-A en tant que nouvel aliment et modifiant le règlement d'exécution (UE) 2017/2470.
Tableaux et figures
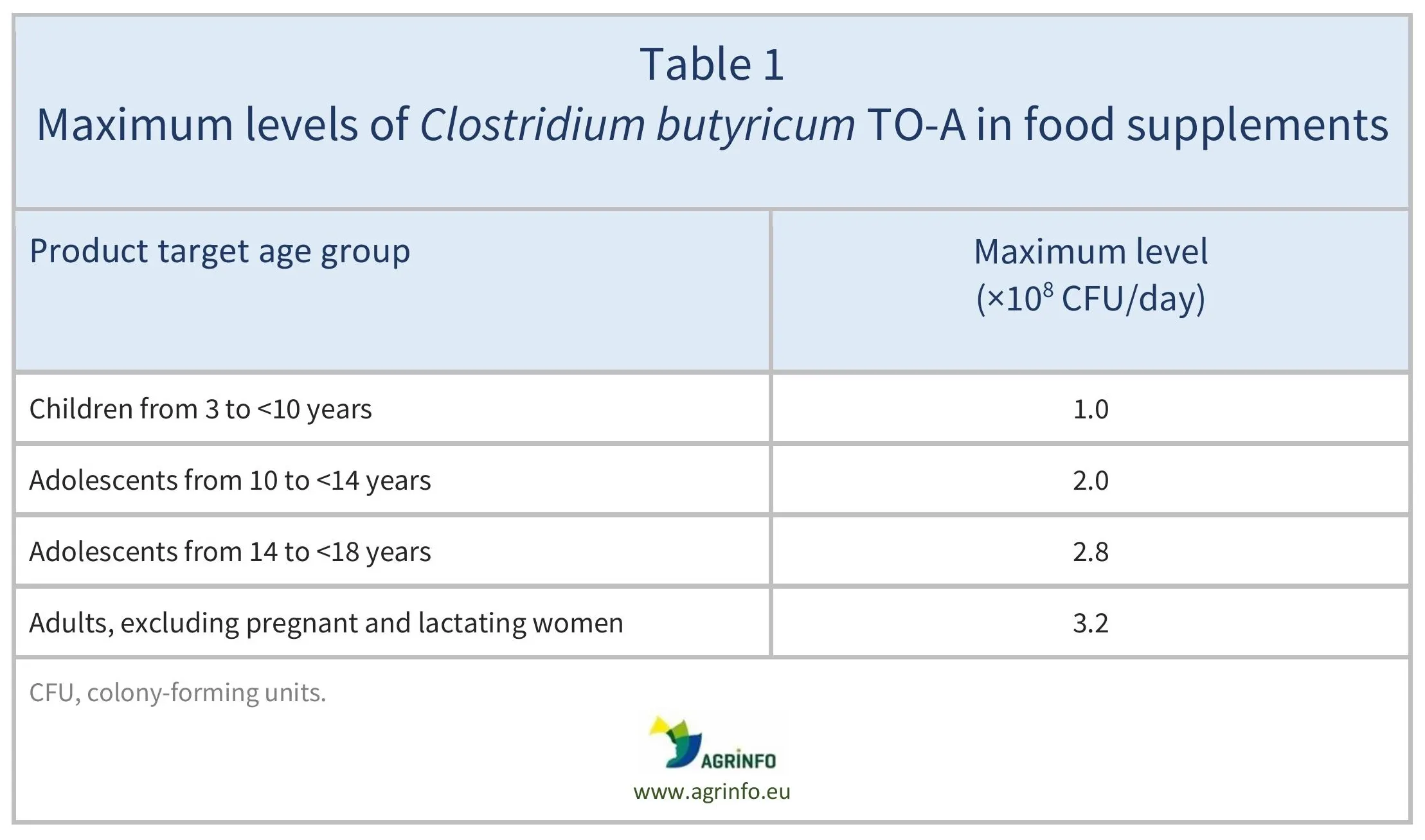
Source: based on Regulation 2025/2233
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.
L'UE autorise l'utilisation du nouvel aliment Clostridium butyricum TO-A
Commission Implementing Regulation (EU) 2025/2233 authorising the placing on the market of Clostridium butyricum TO-A as a novel food and amending Implementing Regulation (EU) 2017/2470.
qu'est-ce qui change et pourquoi ?
L'Union européenne (UE) a autorisé le nouvel aliment Clostridium butyricum TO-A à être utilisé dans les compléments alimentaires destinés à la population générale âgée de plus de 3 ans, à l'exclusion des femmes enceintes et allaitantes, lorsqu'il ne dépasse pas des niveaux maximaux spécifiques (voir tableau 1). Des exigences spécifiques en matière d'étiquetage s'appliquent.
Seule l'entreprise qui a demandé l'autorisation, TOA Biopharma Co. Ltd, est autorisée à vendre ce nouvel aliment sur le marché de l'UE au cours des cinq prochaines années, à moins qu'elle n'autorise la commercialisation par d'autres entreprises ou qu'une autre entreprise obtienne une autorisation de nouvel aliment sans faire référence aux données scientifiques protégées par TOA Biopharma Co. Ltd.
Calendrier
Ce nouvel aliment pourra être mis sur le marché de l'UE à partir du 27 novembre 2025.
Tableaux et figures

Source: based on Regulation 2025/2233
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.
