Nuevo alimento: Aceite de Schizochytrium
- Food safety
- Novel/traditional foods
Resumen
En noviembre de 2025, la Unión Europea (UE) autorizó nuevas condiciones de uso para el aceite producido a partir de Schizochytrium sp. cepa ATCC PTA-9695 en complementos alimenticios destinados a la población general.
Esto sigue a la autorización previa del aceite producido a partir de la cepa ATCC-20889 de Schizochytrium limacinum como nuevo alimento para su uso en preparados para lactantes (julio de 2025); y la autorización de nuevas condiciones de uso para el aceite producido a partir de la cepa FCC-3204 de Schizochytrium sp. en productos proteínicos, excluidos los análogos lácteos (abril de 2025).
La UE autoriza nuevas condiciones de uso del aceite de Schizochytrium en complementos alimenticios
Reglamento de Ejecución (UE) 2025/2245 de la Comisión, de 7 de noviembre de 2025, por el que se modifica el Reglamento de Ejecución (UE) 2017/2470 en lo que respecta a las condiciones de uso del nuevo alimento Schizochytrium sp. (ATCC PTA-9695) oil
Reglamento de Ejecución (UE) 2025/1515 de la Comisión, de 28 de julio de 2025, por el que se autoriza la comercialización del aceite de Schizochytrium limacinum (ATCC-20889) como nuevo alimento y se modifica el Reglamento de Ejecución (UE) 2017/2470
Reglamento de Ejecución (UE) 2025/688 de la Comisión, de 9 de abril de 2025, por el que se modifica el Reglamento de Ejecución (UE) 2017/2470 en lo que respecta a las condiciones de uso del nuevo alimento Schizochytrium sp. (FCC-3204) oil
Actualización
En noviembre de 2025, la Unión Europea (UE) autorizó nuevas condiciones de uso para el aceite producido a partir de Schizochytrium sp. cepa ATCC PTA-9695 en complementos alimenticios destinados a la población general.
Esto sigue a la autorización previa del aceite producido a partir de la cepa ATCC-20889 de Schizochytrium limacinum como nuevo alimento para su uso en preparados para lactantes (julio de 2025); y la autorización de nuevas condiciones de uso para el aceite producido a partir de la cepa FCC-3204 de Schizochytrium sp. en productos proteínicos, excluidos los análogos lácteos (abril de 2025).
Productos afectados
Productos proteínicos (excluidos los análogos lácteos), nutrición infantil, suplementos
¿qué está cambiando?
En noviembre de 2025, la UE autorizó un aumento del nivel máximo de ácido docosahexaenoico (DHA) permitido en los complementos alimenticios para la población general (mayores de 3 años) que contienen el nuevo alimento aceite de Schizochytrium sp. (ATCC PTA-9695).
Anteriormente, en 2025, la UE autorizó:
- Schizochytrium limacinum ATCC-20889 como nuevo alimento para su uso en preparados para lactantes y preparados de continuación (Reglamento 2025/1515)
- nuevas condiciones de uso para el nuevo alimento Schizochytrium sp. FCC-3204 en productos proteicos destinados a la población general, excluidos los análogos lácteos (productos que utilizan ingredientes vegetales que imitan los productos lácteos) (Reglamento 2025/688).
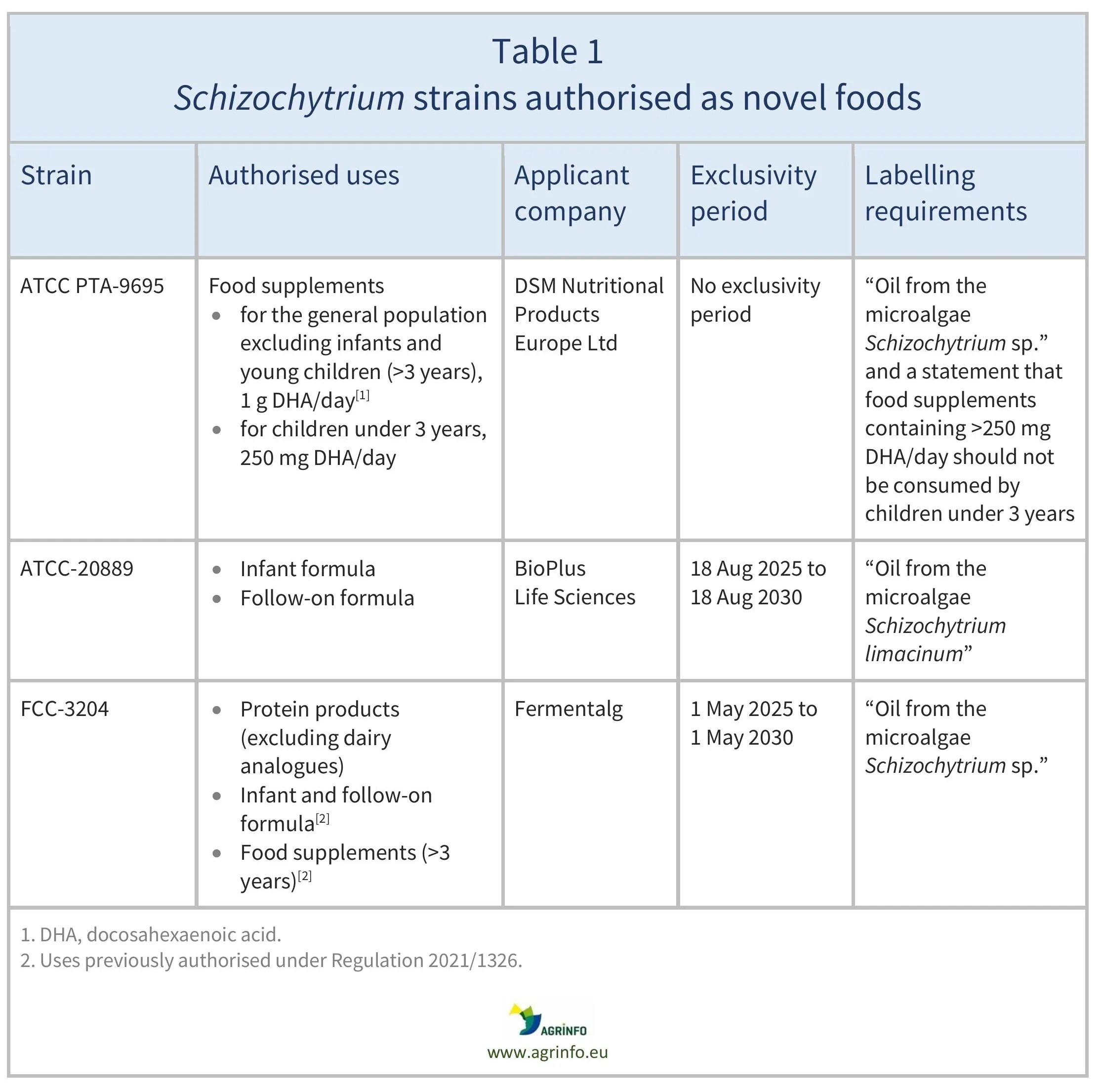
En la tabla 1 se detallan las cepas, los usos autorizados y las empresas que solicitaron la autorización.
Sólo las empresas que solicitaron las autorizaciones de Schizochytrium sp. FCC-3204 en productos proteínicos y de S. limacinum (ATCC-20889) como nuevo alimento para su uso en preparados para lactantes/de continuación podrán comercializar estos nuevos alimentos para los usos autorizados durante un periodo de 5 años (véase el cuadro 1), a menos que estas empresas den permiso a otras para comercializarlos, o si otra empresa obtiene una autorización de nuevo alimento para este uso sin hacer referencia a los datos científicos protegidos en las autorizaciones de nuevos alimentos. No hay periodo de exclusividad para las nuevas condiciones de uso autorizadas para el aceite de Schizochytrium sp. (ATCC PTA-9695).
¿Por qué?
Basándose en evaluaciones anteriores de la Autoridad Europea de Seguridad Alimentaria (EFSA 2012, 2021), la Comisión Europea ha llegado a la conclusión de que el aumento propuesto de los niveles de DHA en los complementos alimenticios no plantea problemas de salud.
LaEFSA (2025) proporcionó una evaluación de seguridad positiva de la cepa ATCC-20889 de S. limacinum.
LaEFSA (2024 ) concluyó que el aceite del nuevo alimento Schizochytrium FCC-3204 es seguro cuando se utiliza en productos proteínicos destinados a la población general, excluidos los análogos lácteos.
Cronología
Nuevas condiciones para el uso de:
- Aceite deSchizochytrium sp. (ATCC PTA-9695) en complementos alimenticios destinados a la población general - se aplicarán a partir del 30 de noviembre de 2025
- Aceite deSchizochytrium (FCC-3204) en productos proteínicos - se aplicarán a partir del 1 de mayo de 2025.
El uso de aceite de S. limacinum (ATCC-20889) en preparados para lactantes/seguimiento está permitido a partir del 18 de agosto de 2025.
Antecedentes
Estos Reglamentos actualizan el anexo del Reglamento 2017/2470, que enumera los nuevos alimentos autorizados (véase la lista de nuevos alimentos de la Unión). Para más información sobre el proceso de autorización de nuevos alimentos de la UE, véase Nuevos alimentos explicados.
Recursos
EFSA (2012) Scientific Opinion on the Tolerable Upper Intake Level of eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA) and docosapentaenoic acid (DPA). Revista de la EFSA, 10(7): 2815.
EFSA (2021) Seguridad del aceite de Schizochytrium limacinum (cepa FCC-3204) para su uso en complementos alimenticios como nuevo alimento de conformidad con el Reglamento (UE) 2015/2283. EFSA Journal, 19(1): 6345.
EFSA (2024) Seguridad de una ampliación del uso de aceite de Schizochytrium limacinum (cepa FCC-3204) como nuevo alimento de conformidad con el Reglamento (UE) 2015/2283. EFSA Journal, 22: e9043.
EFSA (2025) Seguridad del aceite de Schizochytrium limacinum (cepa ATCC-20889) para su uso en preparados para lactantes y preparados de continuación como nuevo alimento de conformidad con el Reglamento (UE) 2015/2283. EFSA Journal, 23(1): e9156.
Reglamento 2021/1326 por el que se autoriza la comercialización de aceite de Schizochytrium sp. (FCC-3204) como nuevo alimento.
Reglamento 2017/2470 por el que se establece la lista de la Unión de nuevos alimentos.
Reglamento 2015/2283 sobre nuevos alimentos.
Fuentes
Reglamento de Ejecución (UE) 2025/2245 de la Comisión por lo que se refiere a las condiciones de uso del nuevo alimento aceite de Schizochytrium sp. (ATCC PTA-9695)
Reglamento de Ejecución (UE) 2025/1515 de la Comisión por el que se autoriza la comercialización del aceite de Schizochytrium limacinum (ATCC-20889) como nuevo alimento
Reglamento de Ejecución (UE) 2025/688 de la Comisión por lo que se refiere a las condiciones de uso del nuevo alimento Schizochytrium sp. (FCC-3204) oil
Descargo de responsabilidad: COLEAD no se hace responsable de ninguna pérdida, daño, responsabilidad o gasto incurrido o sufrido como resultado de la utilización de la información disponible en este sitio web o de cualquier enlace a sitios externos. El uso del sitio web es por cuenta y riesgo exclusivo del usuario. Esta plataforma de información ha sido elaborada y mantenida con el apoyo financiero de la Unión Europea. No obstante, su contenido no refleja las opiniones de la Unión Europea.
La UE autoriza nuevas condiciones de uso del aceite de Schizochytrium en complementos alimenticios
Commission Implementing Regulation (EU) 2025/2245 as regards the conditions of use of the novel food Schizochytrium sp. (ATCC PTA-9695) oil
Commission Implementing Regulation (EU) 2025/1515 authorising the placing on the market of Schizochytrium limacinum (ATCC-20889) oil as a novel food
Commission Implementing Regulation (EU) 2025/688 as regards the conditions of use of the novel food Schizochytrium sp. (FCC-3204) oil
¿qué está cambiando y por qué?
La Unión Europea (UE) ha autorizado el uso del aceite del nuevo alimento Schizochytrium sp. (ATCC PTA-9695) en complementos alimenticios destinados a la población general, lo que permite aumentar los niveles de ácido docosahexaenoico (DHA).
Esto sigue a la autorización, a principios de 2025, de:
- Schizochytrium limacinum (ATCC-20889) como nuevo alimento para su uso en preparados para lactantes y preparados de continuación
- nuevas condiciones de uso para el nuevo alimento Schizochytrium sp. (FCC-3204) aceite en productos proteínicos.
En el cuadro 1 se detallan las cepas, los usos autorizados y las empresas que solicitaron estas autorizaciones.
Cronología
Nuevas condiciones para el uso de:
- Aceite deSchizochytrium sp. (ATCC PTA-9695) en complementos alimenticios destinados a la población general - se aplicarán a partir del 30 de noviembre de 2025
- Aceite deSchizochytrium sp. (FCC-3204) en productos proteínicos - se aplicarán a partir del 1 de mayo de 2025.
Se permite el uso de aceite de S. limacinum (ATCC-20889) en preparados para lactantes y niños de continuación a partir del 18 de agosto de 2025.
Descargo de responsabilidad: COLEAD no se hace responsable de ninguna pérdida, daño, responsabilidad o gasto incurrido o sufrido como resultado de la utilización de la información disponible en este sitio web o de cualquier enlace a sitios externos. El uso del sitio web es por cuenta y riesgo exclusivo del usuario. Esta plataforma de información ha sido elaborada y mantenida con el apoyo financiero de la Unión Europea. No obstante, su contenido no refleja las opiniones de la Unión Europea.