Nouvel aliment : L'huile de schizochytrium
- Food safety
- Novel/traditional foods
Résumé
En novembre 2025, l'Union européenne (UE) a autorisé de nouvelles conditions d'utilisation de l'huile produite à partir de la souche ATCC PTA-9695 de Schizochytrium sp. dans les compléments alimentaires destinés à la population générale.
Cette autorisation fait suite à l'autorisation précédente de l'huile produite à partir de la souche ATCC-20889 de Schizochytrium limacinum en tant que nouvel aliment destiné à être utilisé dans les préparations pour nourrissons et les préparations de suite (juillet 2025), et à l'autorisation de nouvelles conditions d'utilisation de l'huile produite à partir de la souche FCC-3204 de Schizochytrium sp. dans les produits protéiques, à l'exclusion des analogues de produits laitiers (avril 2025).
L'UE autorise de nouvelles conditions d'utilisation de l'huile de Schizochytrium dans les compléments alimentaires
Règlement d'exécution (UE) 2025/2245 de la Commission du 7 novembre 2025 modifiant le règlement d'exécution (UE) 2017/2470 en ce qui concerne les conditions d'utilisation de l'huile du nouvel aliment Schizochytrium sp. (ATCC PTA-9695)
Règlement d'exécution (UE) 2025/1515 de la Commission du 28 juillet 2025 autorisant la mise sur le marché de l'huile de Schizochytrium limacinum (ATCC-20889) en tant que nouvel aliment et modifiant le règlement d'exécution (UE) 2017/2470
Règlement d'exécution (UE) 2025/688 de la Commission du 9 avril 2025 modifiant le règlement d'exécution (UE) 2017/2470 en ce qui concerne les conditions d'utilisation du nouvel aliment Schizochytrium sp. (FCC-3204) oil
Mise à jour
En novembre 2025, l'Union européenne (UE) a autorisé de nouvelles conditions d'utilisation de l'huile produite à partir de la souche ATCC PTA-9695 de Schizochytrium sp. dans les compléments alimentaires destinés à la population générale.
Cette autorisation fait suite à l'autorisation précédente de l'huile produite à partir de la souche ATCC-20889 de Schizochytrium limacinum en tant que nouvel aliment destiné à être utilisé dans les préparations pour nourrissons et les préparations de suite (juillet 2025), et à l'autorisation de nouvelles conditions d'utilisation de l'huile produite à partir de la souche FCC-3204 de Schizochytrium sp. dans les produits protéiques, à l'exclusion des analogues de produits laitiers (avril 2025).
Produits concernés
Produits protéiques (à l'exclusion des analogues de produits laitiers), nutrition infantile, suppléments
qu'est-ce qui change ?
En novembre 2025, l'UE a autorisé une augmentation de la teneur maximale en acide docosahexaénoïque (DHA) autorisée dans les compléments alimentaires destinés à la population générale (âgée de plus de 3 ans) contenant l'huile du nouvel aliment Schizochytrium sp. (ATCC PTA-9695).
Plus tôt en 2025, l'UE a autorisé :
- Schizochytrium limacinum ATCC-20889 en tant que nouvel aliment destiné à être utilisé dans les préparations pour nourrissons et les préparations de suite (règlement 2025/1515)
- de nouvelles conditions d'utilisation pour le nouvel aliment Schizochytrium sp. FCC-3204 dans les produits protéiques destinés à la population générale, à l'exclusion des analogues de produits laitiers (produits utilisant des ingrédients d'origine végétale qui imitent les produits laitiers) (règlement 2025/688).
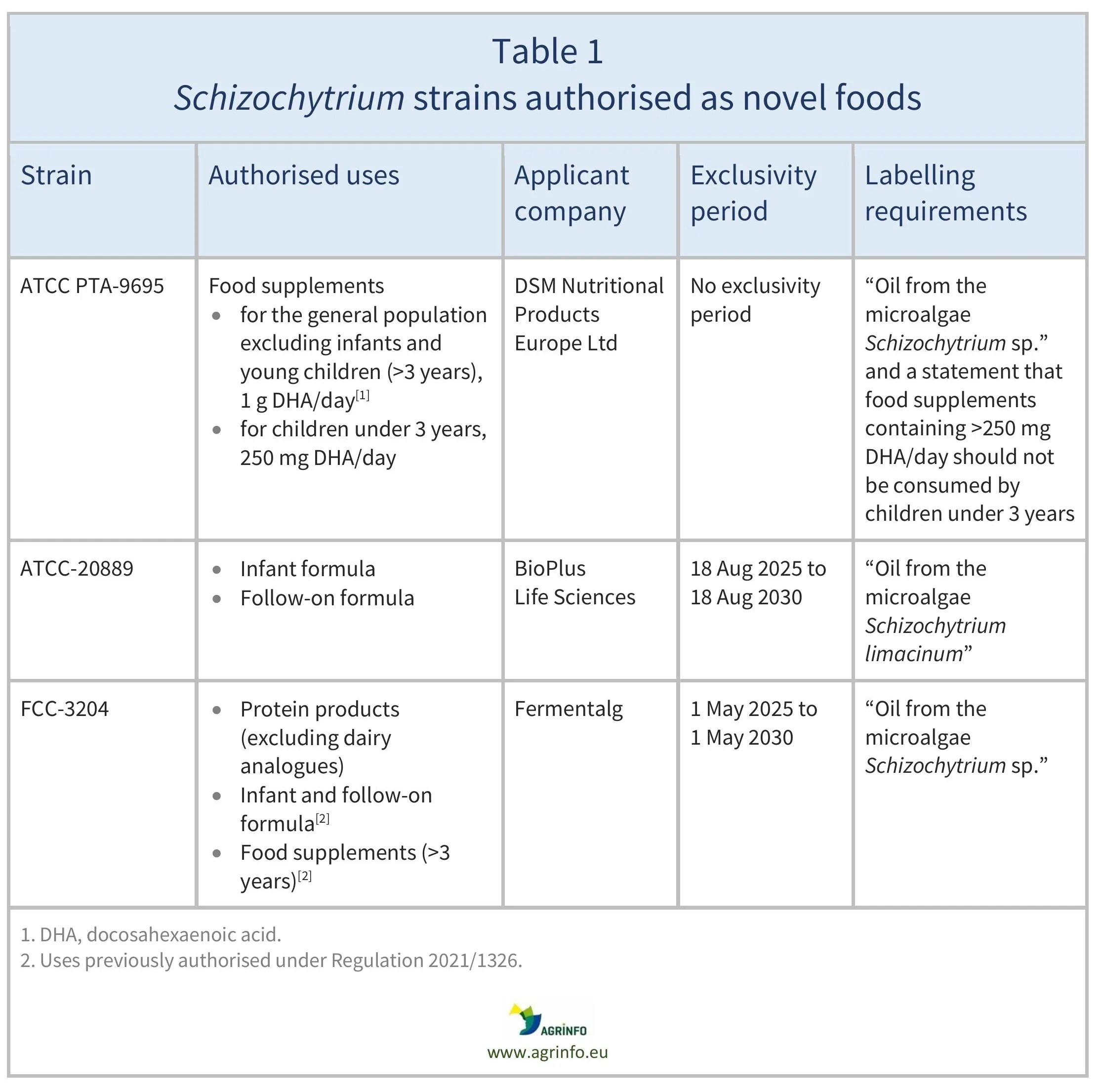
Le tableau 1 fournit des détails sur les souches, les utilisations autorisées et les entreprises qui ont demandé une autorisation.
Seules les entreprises qui ont demandé l'autorisation de Schizochytrium sp. FCC-3204 dans les produits protéiques et de S. limacinum (ATCC-20889) en tant que nouvel aliment destiné à être utilisé dans les préparations pour nourrissons et les préparations de suite peuvent commercialiser ces nouveaux aliments pour les utilisations autorisées pendant une période de cinq ans (voir le tableau 1), à moins que ces entreprises n'autorisent d'autres entreprises à les commercialiser ou qu'une autre entreprise n'obtienne une autorisation de nouvel aliment pour cette utilisation sans faire référence aux données scientifiques protégées dans les autorisations de nouveaux aliments. Il n'y a pas de période d'exclusivité pour les conditions d'utilisation nouvellement autorisées de l'huile de Schizochytrium sp. (ATCC PTA-9695).
pourquoi ?
Sur la base d'évaluations antérieures de l'Autorité européenne de sécurité des aliments (EFSA 2012, 2021), la Commission européenne a conclu que l'augmentation proposée des niveaux de DHA dans les compléments alimentaires ne soulevait pas de problèmes de santé.
L'EFSA (2025) a fourni une évaluation positive de la sécurité de la souche ATCC-20889 de S. limacinum.
L'EFSA (2024) a conclu que l'huile du nouvel aliment Schizochytrium FCC-3204 est sûre lorsqu'elle est utilisée dans des produits protéiques destinés à la population générale, à l'exclusion des analogues laitiers.
Calendrier
Nouvelles conditions d'utilisation de :
- L'huile deSchizochytrium sp. (ATCC PTA-9695) dans les compléments alimentaires destinés à la population générale - s'appliquent à partir du 30 novembre 2025
- L'huile deSchizochytrium (FCC-3204) dans les produits protéiques - s'applique à partir du 1er mai 2025.
L'utilisation de l'huile de S. limacinum (ATCC-20889) dans les préparations pour nourrissons et les préparations de suite est autorisée à partir du 18 août 2025.
Contexte
Ce règlement met à jour l'annexe du règlement 2017/2470 qui dresse la liste des nouveaux aliments autorisés (voir la liste des nouveaux aliments de l'Union). Pour plus d'informations sur le processus d'autorisation des nouveaux aliments dans l'Union, voir Les nouveaux aliments expliqués.
Ressources
EFSA (2012) Avis scientifique sur l'apport maximal tolérable d'acide eicosapentaénoïque (EPA), d'acide docosahexaénoïque (DHA) et d'acide docosapentaénoïque (DPA). Journal de l'EFSA, 10(7) : 2815.
EFSA (2021) Sécurité de l'huile de Schizochytrium limacinum (souche FCC-3204) destinée à être utilisée dans les compléments alimentaires en tant que nouvel aliment conformément au règlement (UE) 2015/2283. EFSA Journal, 19(1) : 6345.
EFSA (2024) Sécurité d'une extension de l'utilisation de l'huile de Schizochytrium limacinum (souche FCC-3204) en tant que nouvel aliment en application du règlement (UE) 2015/2283. EFSA Journal, 22 : e9043.
EFSA (2025) Safety of oil from Schizochytrium limacinum (strain ATCC-20889) for use in infant and follow-on formula as a novel food pursuant to Regulation (EU) 2015/2283. EFSA Journal, 23(1) : e9156.
Règlement 2021/1326 autorisant la mise sur le marché de l'huile de Schizochytrium sp. (FCC-3204) en tant que nouvel aliment.
Règlement 2017/2470 établissant la liste de l'Union des nouveaux aliments.
Règlement 2015/2283 relatif aux nouveaux aliments.
Sources
Règlement d'exécution (UE) 2025/2245 de la Commission concernant les conditions d'utilisation de l'huile de Schizochytrium sp. (ATCC PTA-9695) en tant que nouvel aliment
Règlement d'exécution (UE) 2025/1515 de la Commission autorisant la mise sur le marché de l'huile de Schizochytrium limacinum (ATCC-20889) en tant que nouvel aliment
Règlement d'exécution (UE) 2025/688 de la Commission concernant les conditions d'utilisation de l'huile de Schizochytrium sp. (FCC-3204) en tant que nouvel aliment
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.
L'UE autorise de nouvelles conditions d'utilisation de l'huile de Schizochytrium dans les compléments alimentaires
Commission Implementing Regulation (EU) 2025/2245 as regards the conditions of use of the novel food Schizochytrium sp. (ATCC PTA-9695) oil
Commission Implementing Regulation (EU) 2025/1515 authorising the placing on the market of Schizochytrium limacinum (ATCC-20889) oil as a novel food
Commission Implementing Regulation (EU) 2025/688 as regards the conditions of use of the novel food Schizochytrium sp. (FCC-3204) oil
qu'est-ce qui change et pourquoi ?
L'Union européenne (UE) a autorisé l'utilisation de l'huile du nouvel aliment Schizochytrium sp. (ATCC PTA-9695) dans les compléments alimentaires destinés à la population générale, permettant d'augmenter les niveaux d'acide docosahexaénoïque (DHA).
Cette décision fait suite à l'autorisation, en 2025, de l'huile de Schizochytrium sp :
- Schizochytrium limacinum (ATCC-20889) en tant que nouvel aliment destiné à être utilisé dans les préparations pour nourrissons et les préparations de suite
- de nouvelles conditions d'utilisation pour le nouvel aliment Schizochytrium sp. (FCC-3204) en tant qu'huile dans les produits protéiques.
Le tableau 1 fournit des détails sur les souches, les utilisations autorisées et les entreprises qui ont demandé ces autorisations.
Calendrier
Nouvelles conditions d'utilisation de :
- L'huile deSchizochytrium sp. (ATCC PTA-9695) dans les compléments alimentaires destinés à la population générale - s'appliquent à partir du 30 novembre 2025
- L'huile deSchizochytrium sp. (FCC-3204) dans les produits protéiques - s'applique à partir du 1er mai 2025.
L'utilisation de l'huile de S. limacinum (ATCC-20889) dans les préparations pour nourrissons et les préparations de suite est autorisée à partir du 18 août 2025.
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.