Novo alimento: Óleo de Schizochytrium
- Food safety
- Novel/traditional foods
Resumo
Em novembro de 2025, a União Europeia (UE) autorizou novas condições de utilização do óleo produzido a partir da estirpe ATCC PTA-9695 de Schizochytrium sp. em suplementos alimentares destinados à população em geral.
Esta autorização vem no seguimento da anterior autorização do óleo produzido a partir da estirpe ATCC-20889 de Schizochytrium limacinum como novo alimento para utilização em fórmulas para lactentes/bebés de transição (julho de 2025); e da autorização de novas condições de utilização do óleo produzido a partir da estirpe FCC-3204 de Schizochytrium sp. em produtos proteicos, excluindo análogos de produtos lácteos (abril de 2025).
A UE autoriza novas condições de utilização do óleo de Schizochytrium em suplementos alimentares
Regulamento de Execução (UE) 2025/2245 da Comissão, de 7 de novembro de 2025, que altera o Regulamento de Execução (UE) 2017/2470 no que diz respeito às condições de utilização do óleo de Schizochytrium sp. (ATCC PTA-9695), um novo alimento
Regulamento de Execução (UE) 2025/1515 da Comissão, de 28 de julho de 2025, que autoriza a colocação no mercado de óleo de Schizochytrium limacinum (ATCC-20889) como novo alimento e que altera o Regulamento de Execução (UE) 2017/2470
Regulamento de Execução (UE) 2025/688 da Comissão, de 9 de abril de 2025, que altera o Regulamento de Execução (UE) 2017/2470 no que diz respeito às condições de utilização do óleo de Schizochytrium sp. (FCC-3204) como novo alimento
Atualização
Em novembro de 2025, a União Europeia (UE) autorizou novas condições de utilização do óleo produzido a partir da estirpe ATCC PTA-9695 de Schizochytrium sp. em suplementos alimentares destinados à população em geral.
Esta autorização vem no seguimento da anterior autorização do óleo produzido a partir da estirpe ATCC-20889 de Schizochytrium limacinum como novo alimento para utilização em fórmulas para lactentes/bebés de transição (julho de 2025); e da autorização de novas condições de utilização do óleo produzido a partir da estirpe FCC-3204 de Schizochytrium sp. em produtos proteicos, excluindo análogos de produtos lácteos (abril de 2025).
Produtos afetados
Produtos proteicos (exceto análogos do leite), nutrição infantil, suplementos
o que está a mudar?
Em novembro de 2025, a UE autorizou um aumento do teor máximo de ácido docosahexaenóico (DHA) permitido em suplementos alimentares para a população em geral (com mais de 3 anos de idade) que contenham o óleo de Schizochytrium sp. (ATCC PTA-9695), um novo alimento.
No início de 2025, a UE autorizou:
- Schizochytrium limacinum ATCC-20889 como novo alimento para utilização em fórmulas para lactentes e fórmulas de transição (Regulamento 2025/1515)
- novas condições de utilização do novo alimento Schizochytrium sp. FCC-3204 em produtos proteicos destinados à população em geral, excluindo os análogos dos produtos lácteos (produtos que utilizam ingredientes de origem vegetal que imitam os produtos lácteos) (Regulamento 2025/688).
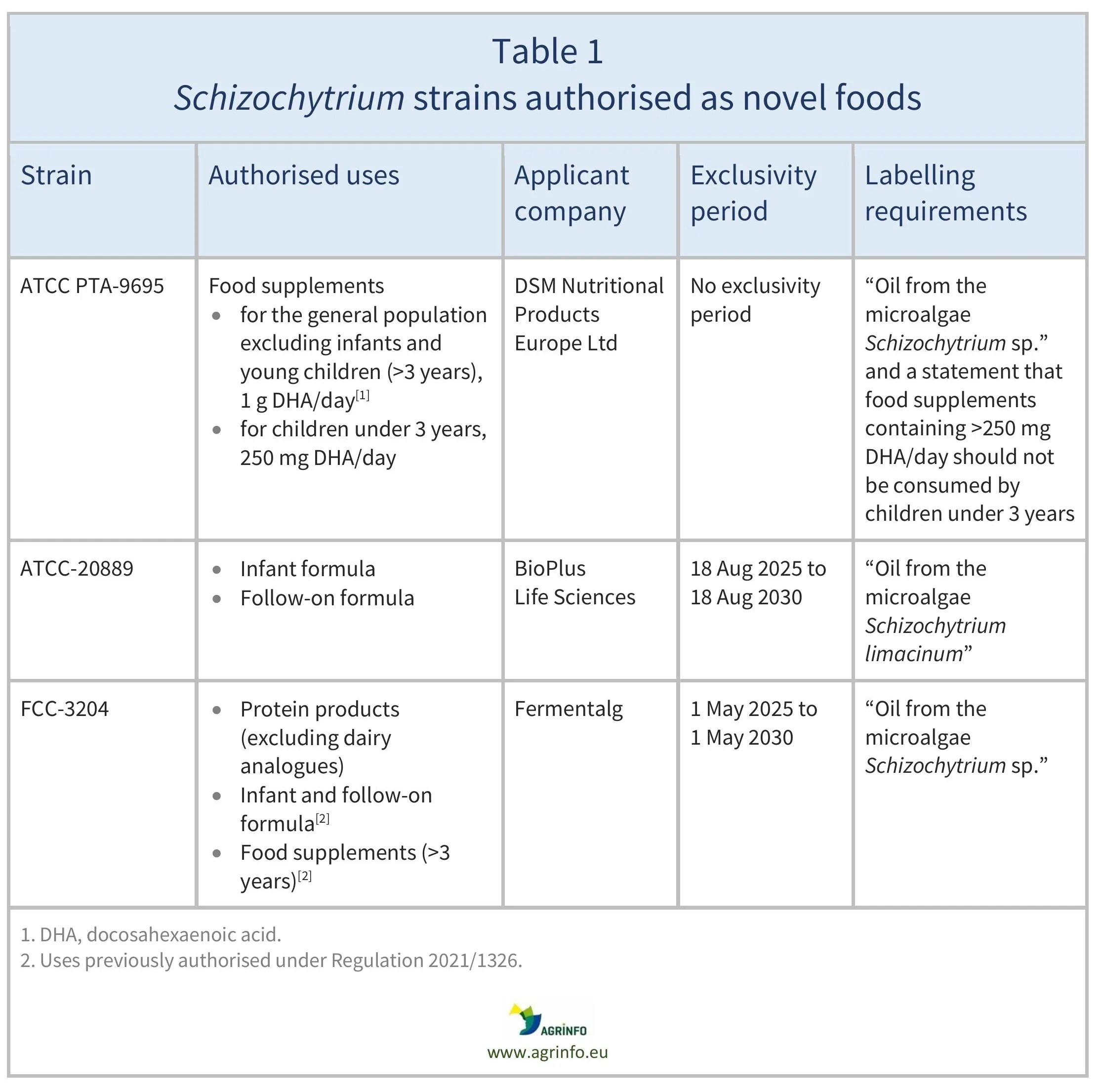
O quadro 1 apresenta pormenores sobre as estirpes, as utilizações autorizadas e as empresas que solicitaram autorização.
Apenas as empresas que solicitaram as autorizações de Schizochytrium sp. FCC-3204 em produtos proteicos e de S. limacinum (ATCC-20889) como novo alimento para utilização em fórmulas para lactentes/bebés de transição podem comercializar estes novos alimentos para as utilizações autorizadas durante um período de 5 anos (ver Quadro 1), a menos que estas empresas autorizem a comercialização por terceiros ou que outra empresa obtenha uma autorização para esta utilização sem referência a dados científicos protegidos nas autorizações de novos alimentos. Não existe um período de exclusividade para as condições de utilização recentemente autorizadas para o óleo de Schizochytrium sp. (ATCC PTA-9695).
porquê?
Com base em avaliações anteriores efectuadas pela Autoridade Europeia para a Segurança dos Alimentos (EFSA 2012, 2021), a Comissão Europeia concluiu que os níveis mais elevados propostos de DHA nos suplementos alimentares não suscitam preocupações em termos de saúde.
A EFSA (2025) apresentou uma avaliação de segurança positiva da estirpe ATCC-20889 de S. limacinum.
A EFSA (2024) concluiu que o óleo de Schizochytrium FCC-3204, um novo alimento, é seguro quando utilizado em produtos proteicos destinados à população em geral, excluindo os análogos do leite.
Cronologia
Novas condições de utilização de:
- Óleode Schizochytrium sp. (ATCC PTA-9695) em suplementos alimentares destinados à população em geral - aplicam-se a partir de 30 de novembro de 2025
- Óleode Schizochytrium (FCC-3204) em produtos proteicos - aplicam-se a partir de 1 de maio de 2025.
A utilização de óleo de S. limacinum (ATCC-20889) em fórmulas para lactentes/bebés de transição é permitida a partir de 18 de agosto de 2025.
Contexto legal
Estes regulamentos actualizam o anexo do Regulamento 2017/2470 que enumera os novos alimentos autorizados (ver a lista da União de novos alimentos). Para mais informações sobre o processo de autorização de novos alimentos na UE, consulte Explicação sobre os novos alimentos.
Recursos
EFSA (2012) Scientific Opinion on the Tolerable Upper Intake Level of eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA) and docosapentaenoic acid (DPA). EFSA Journal, 10(7): 2815.
EFSA (2021) Safety of oil from Schizochytrium limacinum (strain FCC-3204) for use in food supplements as a novel food pursuant to Regulation (EU) 2015/2283 [Segurança do óleo de Schizochytrium limacinum (estirpe FCC-3204) para utilização em suplementos alimentares como novo alimento nos termos do Regulamento (UE) 2015/2283]. EFSA Journal, 19(1): 6345.
EFSA (2024) Safety of an extension of use of oil from Schizochytrium limacinum (strain FCC-3204) as a novel food pursuant to Regulation (EU) 2015/2283 [Segurança de uma extensão da utilização de óleo de Schizochytrium limacinum (estirpe FCC-3204) como novo alimento nos termos do Regulamento (UE) 2015/2283]. EFSA Journal, 22: e9043.
EFSA (2025) Safety of oil from Schizochytrium limacinum (strain ATCC-20889) for use in infant and follow-on formula as a novel food pursuant to Regulation (EU) 2015/2283 [Segurança do óleo de Schizochytrium limacinum (estirpe ATCC-20889) para utilização em fórmulas para lactentes e fórmulas de transição como novo alimento nos termos do Regulamento (UE) 2015/2283]. EFSA Journal, 23(1): e9156.
Regulamento 2021/1326 que autoriza a colocação no mercado de óleo de Schizochytrium sp. (FCC-3204) como novo alimento.
Regulamento 2017/2470 que estabelece a lista da União de novos alimentos.
Regulamento 2015/2283 relativo a novos alimentos.
Fontes
Regulamento de Execução (UE) 2025/2245 da Comissão no que se refere às condições de utilização do novo alimento óleo de Schizochytrium sp. (ATCC PTA-9695)
Regulamento de Execução (UE) 2025/1515 da Comissão que autoriza a colocação no mercado de óleo de Schizochytrium limacinum (ATCC-20889) como novo alimento
Regulamento de Execução (UE) 2025/688 da Comissão no que se refere às condições de utilização do novo alimento óleo de Schizochytrium sp. (FCC-3204)
Isenção de responsabilidade: Em nenhuma circunstância a COLEAD será responsável por quaisquer perdas, danos, responsabilidades ou despesas incorridas ou sofridas que sejam alegadamente resultantes da utilização das informações disponíveis neste sítio Web ou de qualquer ligação a sítios externos. A utilização do sítio Web é da exclusiva responsabilidade e risco do utilizador. Esta plataforma de informação foi criada e é mantida com o apoio financeiro da União Europeia. No entanto, o seu conteúdo não reflete as opiniões da União Europeia.
A UE autoriza novas condições de utilização do óleo de Schizochytrium em suplementos alimentares
Commission Implementing Regulation (EU) 2025/2245 as regards the conditions of use of the novel food Schizochytrium sp. (ATCC PTA-9695) oil
Commission Implementing Regulation (EU) 2025/1515 authorising the placing on the market of Schizochytrium limacinum (ATCC-20889) oil as a novel food
Commission Implementing Regulation (EU) 2025/688 as regards the conditions of use of the novel food Schizochytrium sp. (FCC-3204) oil
o que está a mudar e porquê?
A União Europeia (UE) autorizou a utilização do óleo de Schizochytrium sp. (ATCC PTA-9695), um novo alimento, em suplementos alimentares destinados à população em geral, permitindo o aumento dos níveis de ácido docosahexaenóico (DHA).
Este facto segue-se à autorização, no início de 2025, de:
- Schizochytrium limacinum (ATCC-20889) como novo alimento para utilização em fórmulas para lactentes e fórmulas de transição
- novas condições de utilização para o novo alimento Schizochytrium sp. (FCC-3204) óleo em produtos proteicos.
O quadro 1 apresenta pormenores sobre as estirpes, as utilizações autorizadas e as empresas que solicitaram estas autorizações.
Cronologia
Novas condições de utilização de:
- Óleode Schizochytrium sp. (ATCC PTA-9695) em suplementos alimentares destinados à população em geral - aplicam-se a partir de 30 de novembro de 2025
- Óleode Schizochytrium sp. (FCC-3204) em produtos proteicos - aplicam-se a partir de 1 de maio de 2025.
A utilização de óleo de S. limacinum (ATCC-20889) em fórmulas para lactentes/bebés de transição é permitida a partir de 18 de agosto de 2025.
Isenção de responsabilidade: Em nenhuma circunstância a COLEAD será responsável por quaisquer perdas, danos, responsabilidades ou despesas incorridas ou sofridas que sejam alegadamente resultantes da utilização das informações disponíveis neste sítio Web ou de qualquer ligação a sítios externos. A utilização do sítio Web é da exclusiva responsabilidade e risco do utilizador. Esta plataforma de informação foi criada e é mantida com o apoio financeiro da União Europeia. No entanto, o seu conteúdo não reflete as opiniões da União Europeia.