Contrôles officiels de l'utilisation des substances pharmacologiquement actives et de leurs résidus
- Veterinary residues
Résumé
L'UE a publié de nouveaux règlements sur les contrôles officiels des résidus de substances pharmacologiquement actives chez les animaux producteurs d'aliments et dans les produits d'origine animale. Les pays exportateurs doivent soumettre leur plan de contrôle basé sur les risques, offrant des garanties au moins équivalentes à celles des denrées alimentaires produites dans l'UE et tenant compte des exigences relatives à la fréquence minimale d'échantillonnage.
Règles uniformes relatives aux plans de contrôle nationaux des résidus de produits pharmacologiquement actifs chez les animaux producteurs d'aliments et dans les produits d'origine animale
Règlement d'exécution (UE) 2022/1646 de la Commission du 23 septembre 2022 relatif aux modalités pratiques uniformes pour l'exécution des contrôles officiels concernant l'utilisation des substances pharmacologiquement actives autorisées en tant que médicaments vétérinaires ou additifs pour l'alimentation animale et des substances pharmacologiquement actives interdites ou non autorisées et de leurs résidus, ainsi qu'au contenu spécifique des plans de contrôle nationaux pluriannuels et aux modalités particulières de leur élaboration
Mise à jour
L'UE a publié de nouveaux règlements sur les contrôles officiels des résidus de substances pharmacologiquement actives chez les animaux producteurs d'aliments et dans les produits d'origine animale. Les pays exportateurs doivent soumettre leur plan de contrôle basé sur les risques, offrant des garanties au moins équivalentes à celles des denrées alimentaires produites dans l'UE et tenant compte des exigences relatives à la fréquence minimale d'échantillonnage.
Produits concernés
bovins, ovins, caprins, porcins, chevaux, aquaculture, lapin, gibier d'élevage, reptiles, insectes, viande, abats comestibles, boyaux, œufs, lait, produits laitiers, miel
qu'est-ce qui change ?
Deux nouveaux règlements, (UE) 2022/1646 et (UE) 2022/1644, remplacent la directive 96/23/CE relative aux contrôles officiels concernant l'utilisation de substances pharmacologiquement actives autorisées en tant que médicaments vétérinaires ou additifs pour l'alimentation animale chez les animaux vivants et dans les produits d'origine animale.
Les contrôles des produits de base des pays exportateurs vers l'UE s'effectuent à deux niveaux :
- par les pays exportateurs eux-mêmes
- par les autorités de l'État membre au poste de contrôle frontalier de l'État membre.
Plans de contrôle dans les pays exportateurs
Les plans de contrôle des pays exportateurs pour les denrées alimentaires d'origine animale doivent être au moins équivalents à ceux exigés des États membres de l'UE(2022/2292, art. 4 et 9). Les contrôles doivent être basés sur
- les combinaisons de substances et d'espèces, les produits conformément au règlement (UE) 2022/1644 (annexe II)
- la stratégie d'échantillonnage (annexe III)
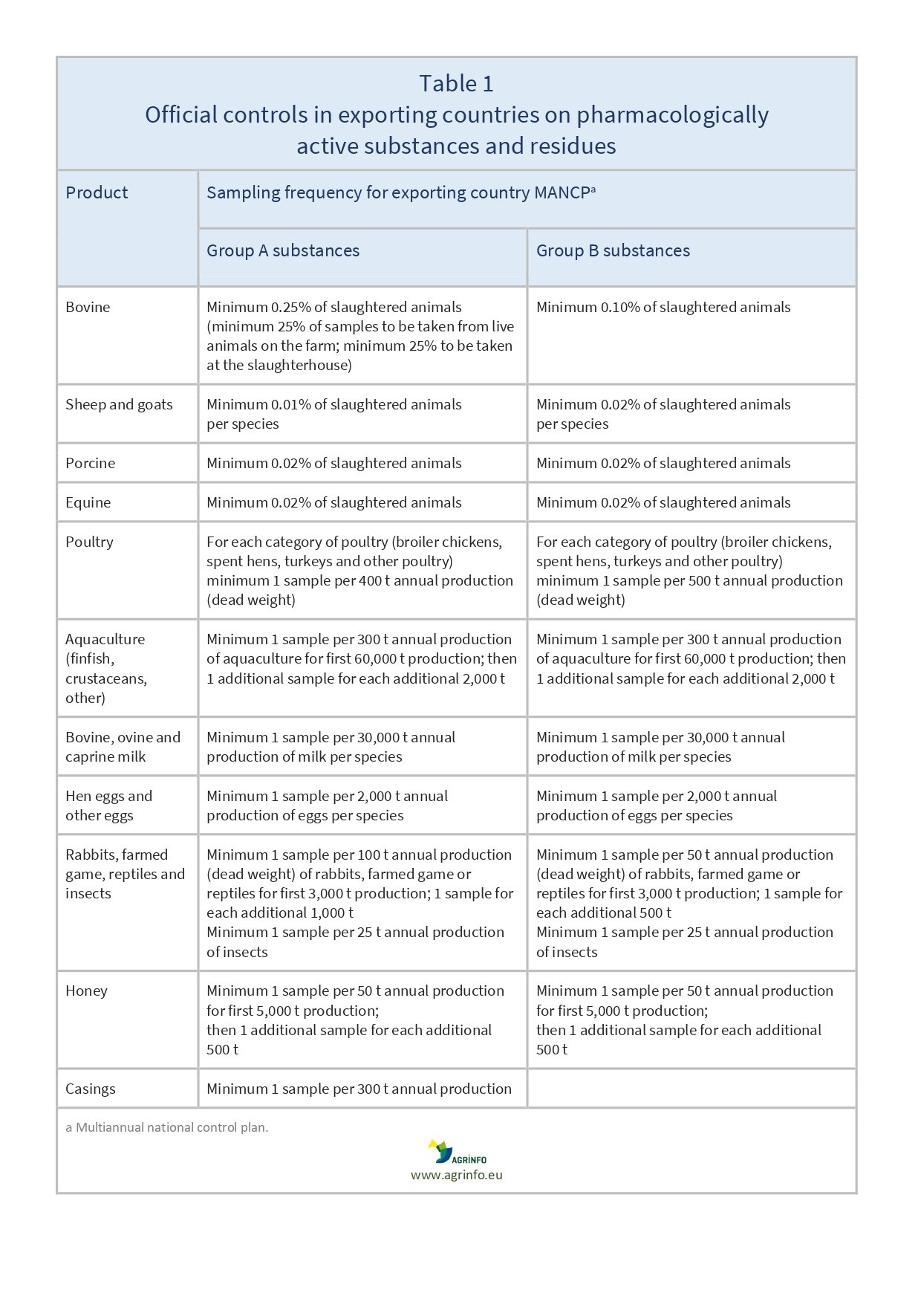
- les fréquences d'échantillonnage effectives, en tenant compte des fréquences de contrôle minimales annuelles (annexe I)
- les méthodes d'analyse à utiliser.
Le nouvel élément est que les contrôles doivent être fondés sur les risques. Les pays exportateurs doivent désormais expliquer leur analyse des risques à l'appui du plan de contrôle qu'ils ont adopté.
Lorsqu'une substance n'est pas autorisée dans l'UE, mais qu'elle l'est dans le pays exportateur, ce dernier doit démontrer l'absence de résidus dans les produits exportés (règlement (UE) 2021/808, annexe I, ou exigences équivalentes).
Lorsqu'une substance interdite dans l'UE est autorisée dans le pays exportateur, celui-ci doit disposer d'un système de production distinct pour ses exportations vers l'UE. Il doit également être en mesure de garantir le respect de conditions strictes, notamment un système approprié d'identification et de traçabilité des animaux permettant de contrôler la distribution des substances interdites, et doit tenir des registres sur l'administration des médicaments vétérinaires(règlement délégué (UE) 2022/2292, art. 10). Les substances interdites dans l'UE comprennent les bêta-agonistes, toutes les substances stilbéniques, thyréostatiques, œstrogènes, androgènes ou gestagènes, le chloramphénicol et les nitrofuranes.
Les fréquences minimales d'échantillonnage sont définies dans le document 2022/1646, annexe I (voir tableau 1). Le plan de contrôle peut couvrir l'ensemble de la production nationale ou uniquement la production éligible à l'exportation vers l'UE. Dans ce dernier cas, une description du système en place est nécessaire pour que seuls les animaux et les produits issus de cette production contrôlée puissent être exportés vers l'UE.
Pour les produits composites, un plan de contrôle n'est pas nécessaire si les composants d'origine animale proviennent d'un État membre ou d'un pays exportateur disposant d'un plan de contrôle approuvé pour les animaux producteurs de denrées alimentaires ou les produits d'origine animale. Dans ce cas, le pays exportateur doit détailler les procédures mises en place pour garantir la traçabilité depuis cette origine (2022/2292, art. 8).
Contrôles aux frontières de l'UE
Les États membres de l'UE doivent disposer d'un plan de contrôle national fondé sur les risques pour les importations en provenance de pays tiers (article 6).
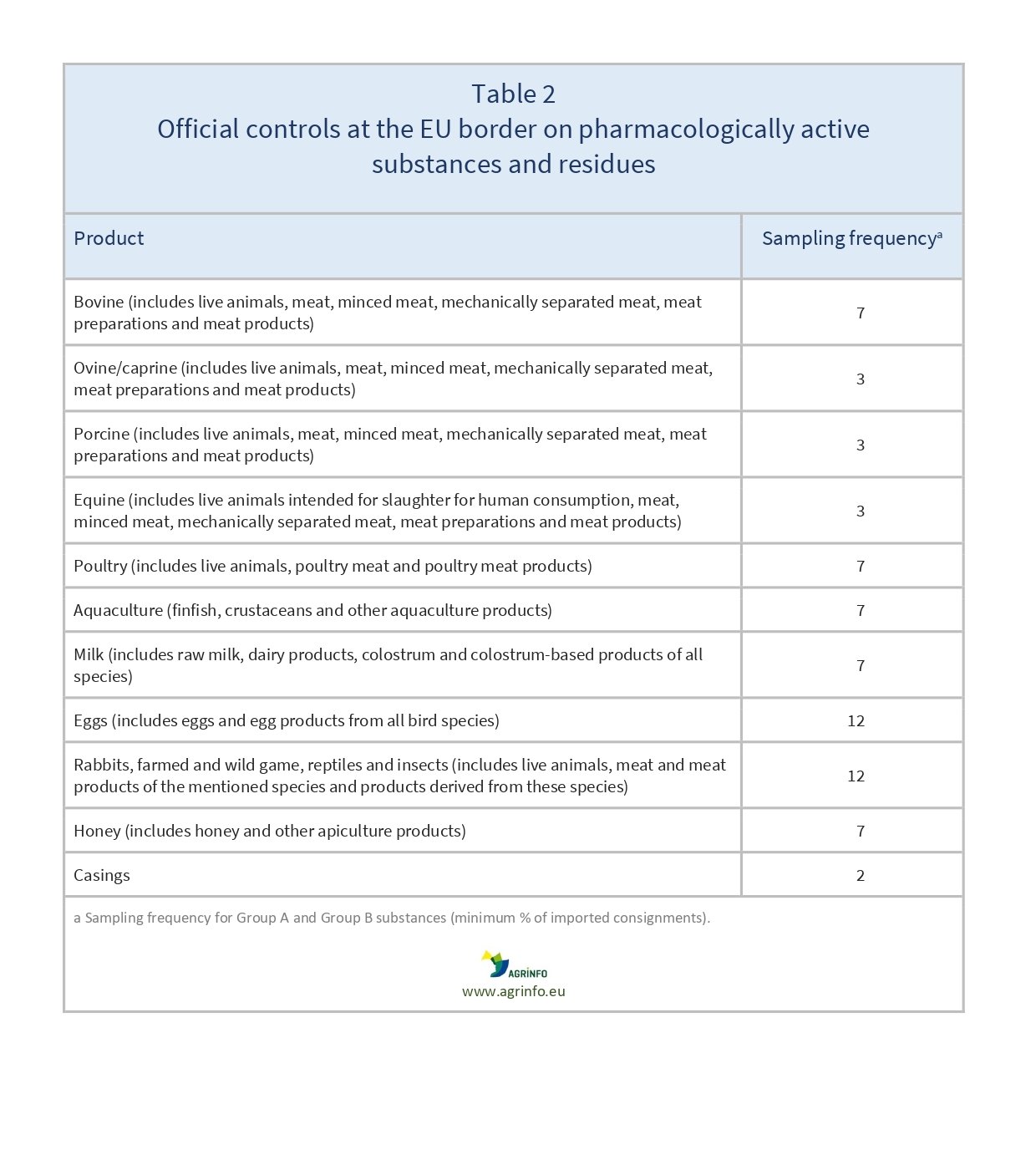
La fréquence minimale d'échantillonnage requise est définie dans le règlement d'application (UE) 2022/1646 (annexe III) (voir tableau 2). Ce règlement couvre tous les animaux d'élevage producteurs de denrées alimentaires et leurs produits (principalement non transformés), y compris les chevaux et les boyaux.
La Commission européenne a mis à jour ses lignes directrices sur les plans de contrôle en mai 2023.
pourquoi ?
La directive 96/23/CE et la décision 97/747/CE ont été abrogées le 14 décembre 2022 et remplacées par le règlement (UE) 2022/1646 concernant :
- le contenu du plan de contrôle national pluriannuel (MANCP) que les États membres doivent élaborer, conformément au règlement relatif aux contrôles officiels(2017/625), afin de garantir l'harmonisation des plans et de permettre la comparaison des données
- les contrôles officiels des résidus de substances à action pharmacologique, la fréquence minimale d'échantillonnage de leurs métabolites et d'autres substances transmissibles aux produits animaux susceptibles de nuire à la santé humaine.
Calendrier
Date de publication : 26 septembre 2022.
Date d'application : 15 décembre 2022.
quelles sont les principales implications pour les pays exportateurs ?
- Comme auparavant, les pays exportant des animaux et des produits animaux vers l'UE doivent préparer leur propre plan de contrôle, afin de s'assurer que leurs exportations sont conformes à la législation de l'UE. La nouveauté réside dans le fait que les contrôles doivent désormais être fondés sur les risques. L'analyse des risques doit expliquer comment les contrôles respectent les fréquences minimales (voir tableau 1).
- En ce qui concerne les contrôles aux postes de contrôle frontaliers de l'UE, les exportations vers l'UE seront systématiquement contrôlées selon la fréquence d'échantillonnage indiquée (voir tableau 2).
- Les pays exportateurs qui présentent des plans de contrôle offrant des garanties équivalentes à celles des États membres, validés par la Commission européenne, seront inclus dans la liste des pays autorisés à exporter les animaux ou produits animaux concernés.
- Aucun plan de contrôle n'est nécessaire pour la gélatine et le collagène, ainsi que les matières premières nécessaires à leur production, les produits d'origine animale hautement raffinés, les insectes, les grenouilles, les cuisses de grenouilles, les escargots, les reptiles et la viande de reptile(2022/2292, art. 5.2).
Actions recommandées
Les pays exportateurs de bovins (bœuf et viande bovine), d'ovins (mouton, agneau, viande ovine), de caprins (chèvre et viande caprine), de porcins (porcs et viande de porc), d'équins (chevaux et viande de cheval), d'aquaculture, de volailles, de lait, d'œufs, de lapins, de gibier sauvage, de miel et de boyaux doivent établir des plans de contrôle annuels pour contrôler les substances du groupe A et du groupe B. Ces plans de contrôle doivent donner les mêmes garanties que ceux des États membres.
Ces plans de contrôle doivent offrir les mêmes garanties que ceux des États membres. La nouveauté réside dans le fait que les plans de contrôle doivent être fondés sur les risques. Cela signifie que les autorités compétentes doivent être en mesure de justifier leur stratégie d'échantillonnage en fonction de la fréquence minimale (voir tableau 1).
Les animaux producteurs de denrées alimentaires et les produits animaux en provenance des pays exportateurs sont systématiquement contrôlés aux postes de contrôle frontaliers de l'UE. Pour éviter toute non-conformité, l'analyse des risques définie dans le plan de contrôle et la fréquence d'échantillonnage requise doivent être rigoureusement conformes aux critères du tableau 2. Les États membres de l'UE tiendront compte de tout antécédent de non-conformité, en particulier des cas signalés dans le cadre du système d'alerte rapide pour les denrées alimentaires et les aliments pour animaux(RASFF), lorsqu'ils contrôleront les produits à leurs postes de contrôle frontaliers. Les contrôles sont susceptibles d'être renforcés lorsque des cas de non-conformité sont détectés.
Les plans de contrôle doivent être soumis chaque année avant le 31 mars. Les modèles mis à jour(lignes directrices sur les plans de contrôle, 4.4) doivent être utilisés pour communiquer les résultats de 2023 au plus tard le 31 mars 2024.
Le modèle Excel est complet et donc plus compliqué qu'auparavant. Pour faciliter son utilisation, il est conseillé aux pays exportateurs de supprimer les sections qui ne les concernent pas. Le modèle couvre les résidus de substances pharmacologiquement actives, de pesticides et de contaminants sous différents onglets. Les onglets (a) à (e) fournissent des informations et des conseils supplémentaires.
Contexte
Le règlement relatif aux contrôles officiels (UE 2017/625) prévoit que les autorités compétentes doivent effectuer des contrôles officiels, à toutes les étapes de la production, de la transformation et de la distribution, sur les résidus de substances pertinentes dans les denrées alimentaires et les aliments pour animaux (y compris les substances à utiliser dans les matériaux en contact avec les denrées alimentaires, les contaminants, les substances non autorisées, interdites et indésirables).
Le règlement délégué (UE) 2022/2292 complète le règlement relatif aux contrôles officiels en ce qui concerne les exigences spécifiques de santé publique applicables aux animaux producteurs de denrées alimentaires et aux produits animaux exportés vers l'UE.
L'ensemble des règlements figurant dans le tableau 3 remplace la directive 96/23/CE.
Le règlement (UE) n° 37/2010 de la Commission fixe les limites maximales de résidus (LMR) des substances pharmacologiquement actives dans les denrées alimentaires d'origine animale.
Le règlement d'application (UE) 2021/808 complète les règlements (2022/1644 et 2022/1646). Il établit des règles concernant les méthodes d'échantillonnage et les analyses de laboratoire pour les résidus de substances pharmacologiquement actives dans les animaux vivants producteurs de denrées alimentaires, leurs parties du corps et leurs fluides, leurs excréments, leurs tissus, les produits d'origine animale, les sous-produits animaux, les aliments pour animaux et l'eau. Il définit également les règles d'interprétation des résultats analytiques.
Le règlement d'exécution (UE) 2021/405 établit la liste des pays (ou régions) exportateurs autorisés à exporter vers l'UE des animaux et des produits animaux destinés à la consommation humaine.
Ressources
Ressources en ligne de la Commission européenne :
- Lignes directrices concernant les conditions d'entrée dans l'UE des animaux et des produits d'origine animale : Plans de contrôle des résidus de médicaments vétérinaires, de pesticides et de contaminants
- Contrôles officiels des produits importés
- Communication de la Commission concernant un document d'orientation sur la mise en œuvre des exigences relatives aux plans de contrôle nationaux pluriannuels
Sources
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.