Dernières autorisations, modifications et extensions de nouveaux aliments 2024
- Food safety
- Novel/traditional foods
Résumé
Ce rapport résume les décisions récentes de l'UE d'autoriser, de modifier ou d'étendre les spécifications ou les conditions d'utilisation des nouveaux aliments existants :
- 2'-FL obtenu par fermentation microbienne à l'aide d'une souche dérivée d'Escherichia coli par Kyowa Hakko Bio Co.
- Mélange LNFP-I/2'-FL obtenu par fermentation microbienne à l'aide d'une souche dérivée d'E. coli
- Huile deSchizochytrium limacinum (TKD-1)
- Huile deSchizochytrium sp. (CABIO-A-2)
- Jus de tige d'ashitaba.
L'UE a autorisé les changements suivants :
- extension de l'utilisation du nouvel aliment Yarrowia lipolytica yeast biomass aux substituts de repas pour le contrôle du poids destinés à la population adulte
- les exigences en matière d'étiquetage "Protéines partiellement hydrolysées d'orge et de riz" pour les denrées alimentaires contenant des protéines partiellement hydrolysées d'orge et de riz épuisés
- les spécifications et conditions d'utilisation de l'extrait protéique de rognons de porc ne feront référence qu'aux teneurs maximales autorisées ; ses différentes formes sont supprimées des spécifications
- des teneurs plus faibles en acide docosahexaénoïque (DHA) dans les spécifications du nouvel aliment Schizochytrium sp. huile riche en DHA et en acide eicosapentaénoïque (EPA)
- les niveaux autorisés de 2'-FL augmenteront par rapport aux niveaux actuels autorisés dans les préparations pour nourrissons et les préparations de suite
- les teneurs en endotoxines résiduelles autorisées pour le 2'-FL produit à partir de la souche dérivée E. coli BL-21 seront alignées sur les teneurs déjà autorisées dans les mêmes conditions d'utilisation pour le 2'-FL produit à partir d'E. coli K-12 et d'autres oligosaccharides du lait à des teneurs résiduelles similaires dans les préparations pour nourrissons et les préparations de suite.
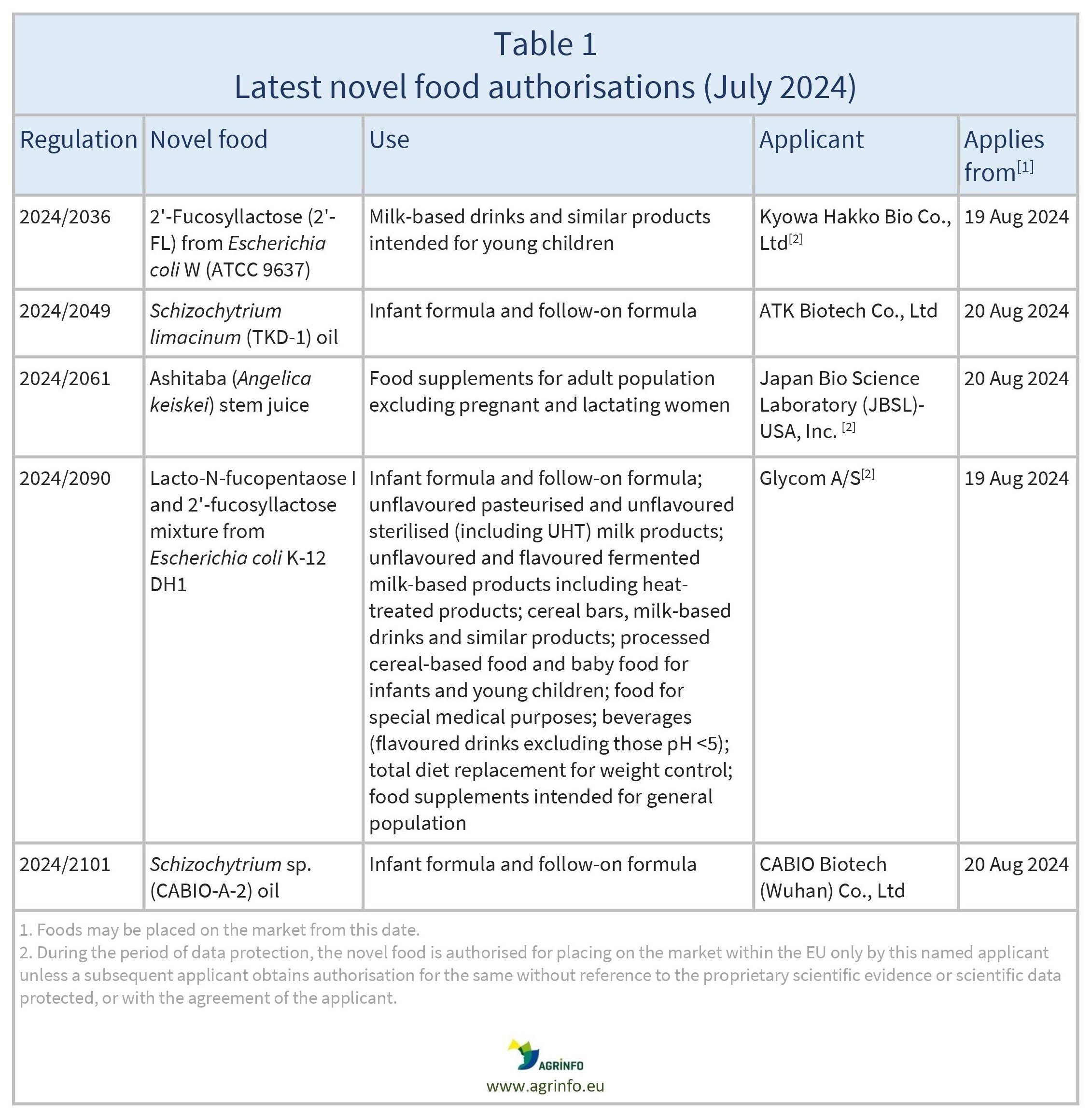
Autorisations de nouveaux aliments, utilisations modifiées et extensions adoptées janvier-juillet 2024
Autorisations
Règlements d'exécution de la Commission 2024/2036, 2024/2049, 2024/2061, 2024/2090, 2024/2101
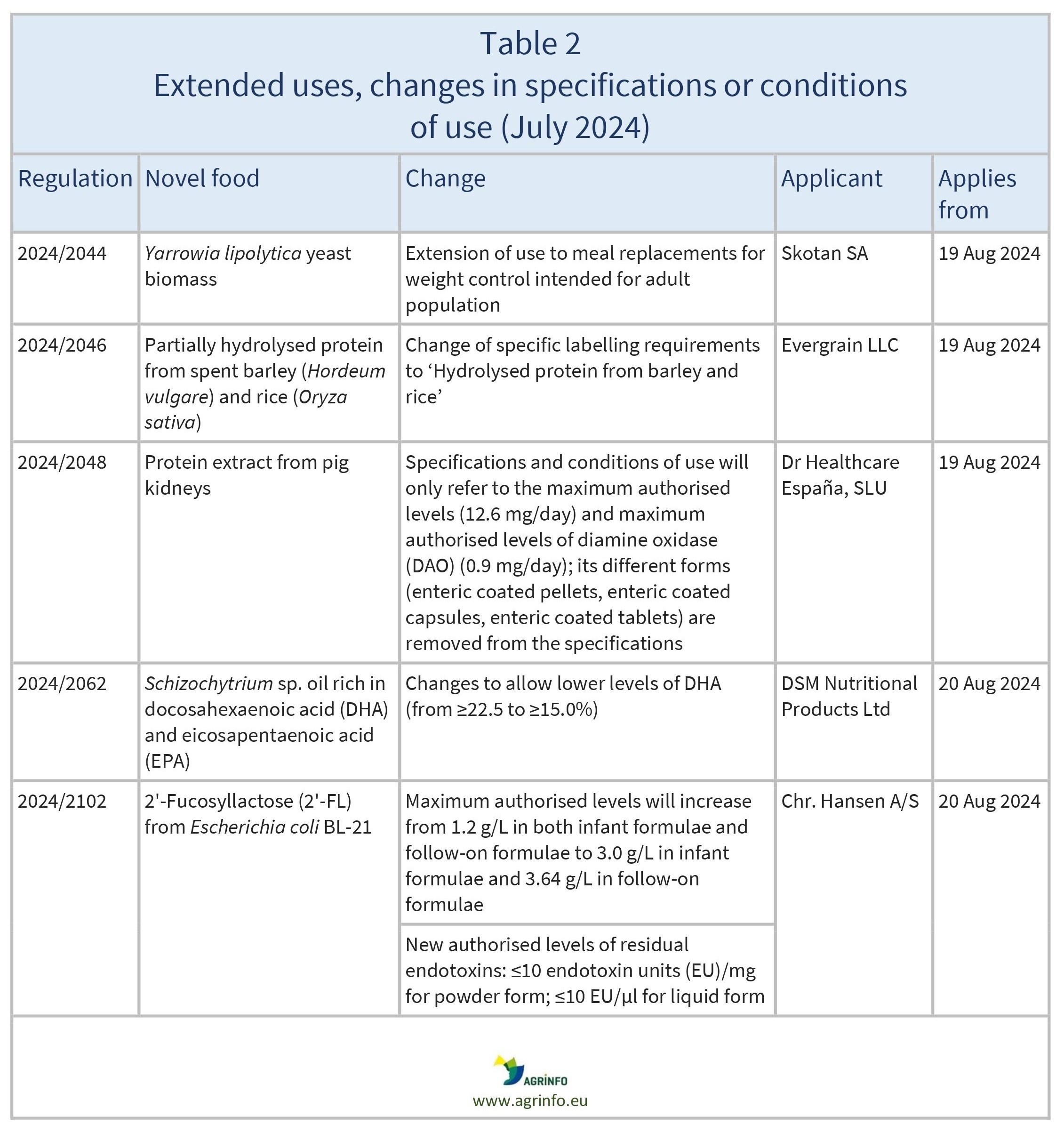
Amendements
Règlements d'application de la Commission 2024/2044, 2024/2046, 2024/2048, 2024/2062, 2024/2102
Mise à jour
Ce rapport résume les décisions récentes de l'UE d'autoriser, de modifier ou d'étendre les spécifications ou les conditions d'utilisation des nouveaux aliments existants :
- 2'-FL obtenu par fermentation microbienne à l'aide d'une souche dérivée d'Escherichia coli par Kyowa Hakko Bio Co.
- Mélange LNFP-I/2'-FL obtenu par fermentation microbienne à l'aide d'une souche dérivée d'E. coli
- Huile deSchizochytrium limacinum (TKD-1)
- Huile deSchizochytrium sp. (CABIO-A-2)
- Jus de tige d'ashitaba.
L'UE a autorisé les changements suivants :
- extension de l'utilisation du nouvel aliment Yarrowia lipolytica yeast biomass aux substituts de repas pour le contrôle du poids destinés à la population adulte
- les exigences en matière d'étiquetage "Protéines partiellement hydrolysées d'orge et de riz" pour les denrées alimentaires contenant des protéines partiellement hydrolysées d'orge et de riz épuisés
- les spécifications et conditions d'utilisation de l'extrait protéique de rognons de porc ne feront référence qu'aux teneurs maximales autorisées ; ses différentes formes sont supprimées des spécifications
- des teneurs plus faibles en acide docosahexaénoïque (DHA) dans les spécifications du nouvel aliment Schizochytrium sp. huile riche en DHA et en acide eicosapentaénoïque (EPA)
- les niveaux autorisés de 2'-FL augmenteront par rapport aux niveaux actuels autorisés dans les préparations pour nourrissons et les préparations de suite
- les teneurs en endotoxines résiduelles autorisées pour le 2'-FL produit à partir de la souche dérivée E. coli BL-21 seront alignées sur les teneurs déjà autorisées dans les mêmes conditions d'utilisation pour le 2'-FL produit à partir d'E. coli K-12 et d'autres oligosaccharides du lait à des teneurs résiduelles similaires dans les préparations pour nourrissons et les préparations de suite.
Produits concernés
Produits laitiers (pasteurisés, stérilisés, UHT), produits à base de lait fermenté, boissons aromatisées, barres de céréales, préparations pour nourrissons, préparations de suite, aliments transformés à base de céréales et aliments pour bébés, aliments de substitution (pour le contrôle du poids), aliments médicaux spéciaux, compléments alimentaires
qu'est-ce qui change ?
La Commission européenne a autorisé la mise sur le marché de l'Union européenne des nouveaux aliments énumérés dans le tableau 1. Ces aliments seront inclus dans la liste de l'Union des nouveaux aliments (règlement 2017/2470). Pour certains nouveaux aliments, seules les entreprises demandeuses qui ont obtenu l'autorisation sont autorisées à les vendre sur le marché de l'UE au cours des cinq prochaines années, sauf si elles autorisent d'autres entreprises à les vendre ou si une autre entreprise obtient une autorisation de nouvel aliment sans faire référence aux données scientifiques protégées utilisées par le demandeur initial (voir la note de bas de page du tableau 1).
La Commission a également autorisé certaines modifications des spécifications et des conditions d'utilisation de certains nouveaux aliments déjà autorisés et disponibles sur le marché de l'UE (voir tableau 2).
pourquoi ?
Seuls les nouveaux aliments autorisés et inclus dans la liste de l'Union des nouveaux aliments peuvent être mis sur le marché au sein de l'UE (règlement 2015/2283).
L'Autorité européenne de sécurité des aliments (EFSA) évalue les demandes de nouveaux aliments afin de garantir leur sécurité dans les conditions et/ou les niveaux d'utilisation proposés [voir Ressources 1-6].
Calendrier
Les nouveaux aliments autorisés peuvent être mis sur le marché de l'UE à partir de la date indiquée dans le tableau 1.
Les modifications des spécifications et des conditions s'appliquent à partir des dates indiquées dans le tableau 2.
Contexte
Pour plus d'informations sur la procédure d'autorisation des nouveaux aliments, voir Les nouveaux aliments expliqués.
Ressources
Commission européenne : Liste de l'Union des nouveaux aliments
Règlement (UE) 2017/2470 (liste de l'Union des nouveaux aliments)
Règlement (UE) 2015/2283 sur les nouveaux aliments
Règlement n° 1169/2011 concernant l'information des consommateurs sur les denrées alimentaires
Avis publiés par l'Autorité européenne de sécurité des aliments (EFSA) sur l'innocuité/l'efficacité des nouveaux aliments suivants :
- EFSA (2023) Sécurité du 2′-fucosyllactose (2′-FL) produit par une souche dérivée (Escherichia coli SGR5) d'E. coli W (ATCC 9637) en tant que nouvel aliment conformément au règlement (UE) 2015/2283. EFSA Journal, 21(11) : 8333.
- EFSA (2023) Sécurité de l'extension de l'utilisation du 2′-fucosyllactose (2′-FL) en tant que nouvel aliment en application du règlement (UE) 2015/2283. EFSA Journal, 21(11) : e8334.
- EFSA (2023) Safety of an extension of use of Yarrowia lipolytica yeast biomass as a novel food pursuant to Regulation (EU) 2015/2283 (Sécurité d'une extension de l'utilisation de la biomasse de la levure Yarrowia lipolytica en tant que nouvel aliment conformément au règlement (UE) 2015/2283). EFSA Journal, 21(11) : e8416.
- EFSA (2023) Safety of lacto-N-fucopentaose I/2'-fucosyllactose (LNFP-I/2'-FL) mixture as a novel food pursuant to Regulation (EU) 2015/2283. EFSA Journal, 21(12) : e8412.
- EFSA (2023) Safety of oil from Schizochytrium limacinum (strain TKD-1) for use in infant and follow-on formula as a novel food pursuant to Regulation (EU) 2015/2283. EFSA Journal, 21(12) : e8414.
- EFSA (2023) Safety of oil from Schizochytrium sp. (strain CABIO-A-2) for use in infant and follow-on formula as a novel food pursuant to Regulation (EU) 2015/2283. EFSA Journal, 21(12) : e8415.
Sources
Règlement d'exécution de la Commission :
2024/2036 autorisant la mise sur le marché du 2'-Fucosyllactose produit par une souche dérivée d'Escherichia coli W (ATCC 9637) en tant que nouvel aliment
2024/2044 en ce qui concerne les spécifications et les conditions d'utilisation du nouvel aliment Yarrowia lipolytica yeast biomass
2024/2046 en ce qui concerne les exigences spécifiques en matière d'étiquetage pour le nouvel aliment protéines partiellement hydrolysées à partir d'orge(Hordeum vulgare) et de riz(Oryza sativa) épuisés
2024/2048 en ce qui concerne les spécifications et les conditions d'utilisation du nouvel aliment "extrait protéique de reins de porc
2024/2049 autorisant la mise sur le marché de l'huile de Schizochytrium limacinum (TKD-1) en tant que nouvel aliment
2024/2061 autorisant la mise sur le marché du jus de tiges d'Angelica keiskei (jus de tiges d'Ashitaba) en tant que nouvel aliment
2024/2062 concernant les spécifications du nouvel aliment Schizochytrium sp. oil rich in DHA and EPA
2024/2090 autorisant la mise sur le marché du mélange Lacto-N-fucopentaose I et 2'-Fucosyllactose produit à l'aide d'une souche dérivée d'Escherichia coli K-12 DH1 en tant que nouvel aliment
2024/2101 autorisant la mise sur le marché de l'huile de Schizochytrium sp. (CABIO-A-2) en tant que nouvel aliment
2024/2102 concernant les conditions d'utilisation du nouvel aliment 2'-Fucosyllactose et les spécifications du nouvel aliment 2'-Fucosyllactose produit à l'aide d'une souche dérivée d'Escherichia coli BL-21
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.
Autorisations de nouveaux aliments, utilisations modifiées et extensions adoptées janvier-juillet 2024
Authorisations
Commission Implementing Regulations 2024/2036, 2024/2049, 2024/2061, 2024/2090, 2024/2101
Amendments
Commission Implementing Regulations 2024/2044, 2024/2046, 2024/2048, 2024/2062, 2024/2102
qu'est-ce qui change et pourquoi ?
La Commission européenne a autorisé la mise sur le marché de l'UE des nouveaux aliments énumérés dans le tableau 1.
Elle a également autorisé certaines modifications des spécifications et des conditions d'utilisation de certains nouveaux aliments déjà autorisés et disponibles sur le marché de l'UE (voir tableau 2).
Calendrier
Les nouveaux aliments autorisés peuvent être mis sur le marché de l'UE à partir de la date indiquée dans le tableau 1.
Les modifications des spécifications et des conditions s'appliquent à partir des dates indiquées dans le tableau 2.
Tableaux et figures
Clause de non-responsabilité : COLEAD ne peut en aucun cas être tenu responsable des pertes, dommages, responsabilités ou dépenses encourus ou subis qui résulteraient de l'utilisation des informations disponibles sur ce site web ou de tout lien vers des sites externes. L'utilisation du site web se fait aux seuls risques et responsabilités de l'utilisateur. Cette plateforme d'information a été créée et maintenue avec le soutien financier de l'Union européenne. Son contenu ne reflète toutefois pas le point de vue de l'Union européenne.