Autorizações, alterações e extensões de novos alimentos mais recentes em 2024
- Food safety
- Novel/traditional foods
Resumo
Este relatório resume as recentes decisões da UE para autorizar, alterar ou alargar as especificações ou condições de utilização de novos alimentos existentes:
- 2'-FL obtido por fermentação microbiana utilizando uma estirpe derivada de Escherichia coli pela Kyowa Hakko Bio Co.
- Mistura LNFP-I/2'-FL obtida por fermentação microbiana utilizando uma estirpe derivada de E. coli
- Óleo deSchizochytrium limacinum (TKD-1)
- Óleode Schizochytrium sp. (CABIO-A-2)
- Sumo do caule de Ashitaba.
A UE autorizou as seguintes alterações
- alargamento da utilização do novo alimento Yarrowia lipolytica yeast biomass aos substitutos de refeição para controlo do peso destinados à população adulta
- requisitos de rotulagem "Proteína parcialmente hidrolisada de cevada e arroz" para alimentos que contenham proteína parcialmente hidrolisada de cevada e arroz usados
- as especificações e condições de utilização do extrato proteico de rim de suíno apenas referem os teores máximos autorizados; as suas diferentes formas são eliminadas das especificações
- teores mais baixos de ácido docosa-hexaenóico (DHA) nas especificações do novo alimento Schizochytrium sp. óleo rico em DHA e ácido eicosapentaenóico (EPA)
- os níveis autorizados de 2'-FL aumentarão em relação aos níveis actuais autorizados tanto nas fórmulas para lactentes como nas fórmulas de transição
- os níveis autorizados de endotoxinas residuais para o 2'-FL produzido a partir da estirpe derivada E. coli BL-21 serão alinhados com os níveis já autorizados nas mesmas condições de utilização para o 2'-FL de E. coli K-12 e outros oligossacáridos do leite com níveis residuais semelhantes em fórmulas para lactentes e fórmulas de transição.
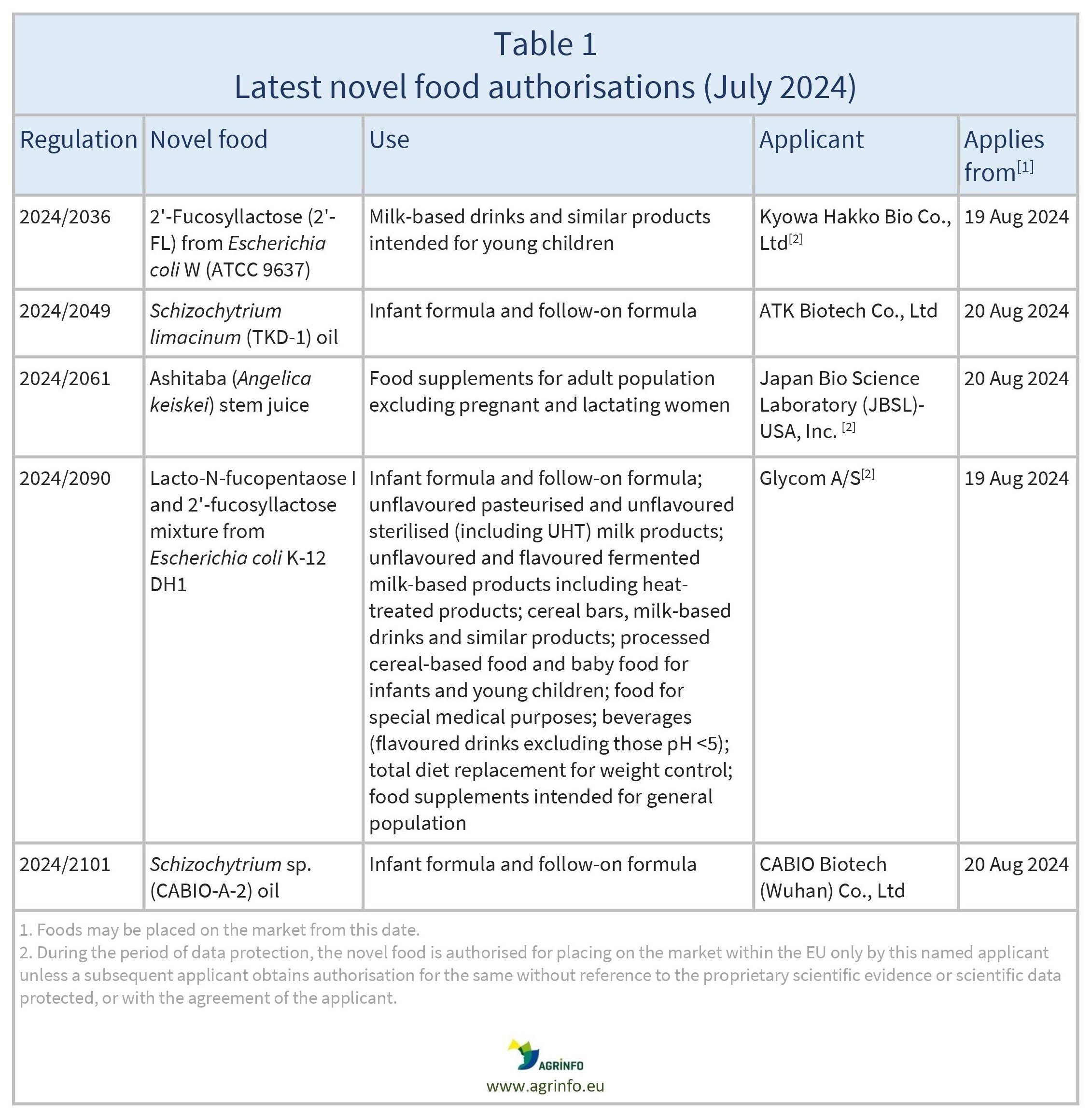
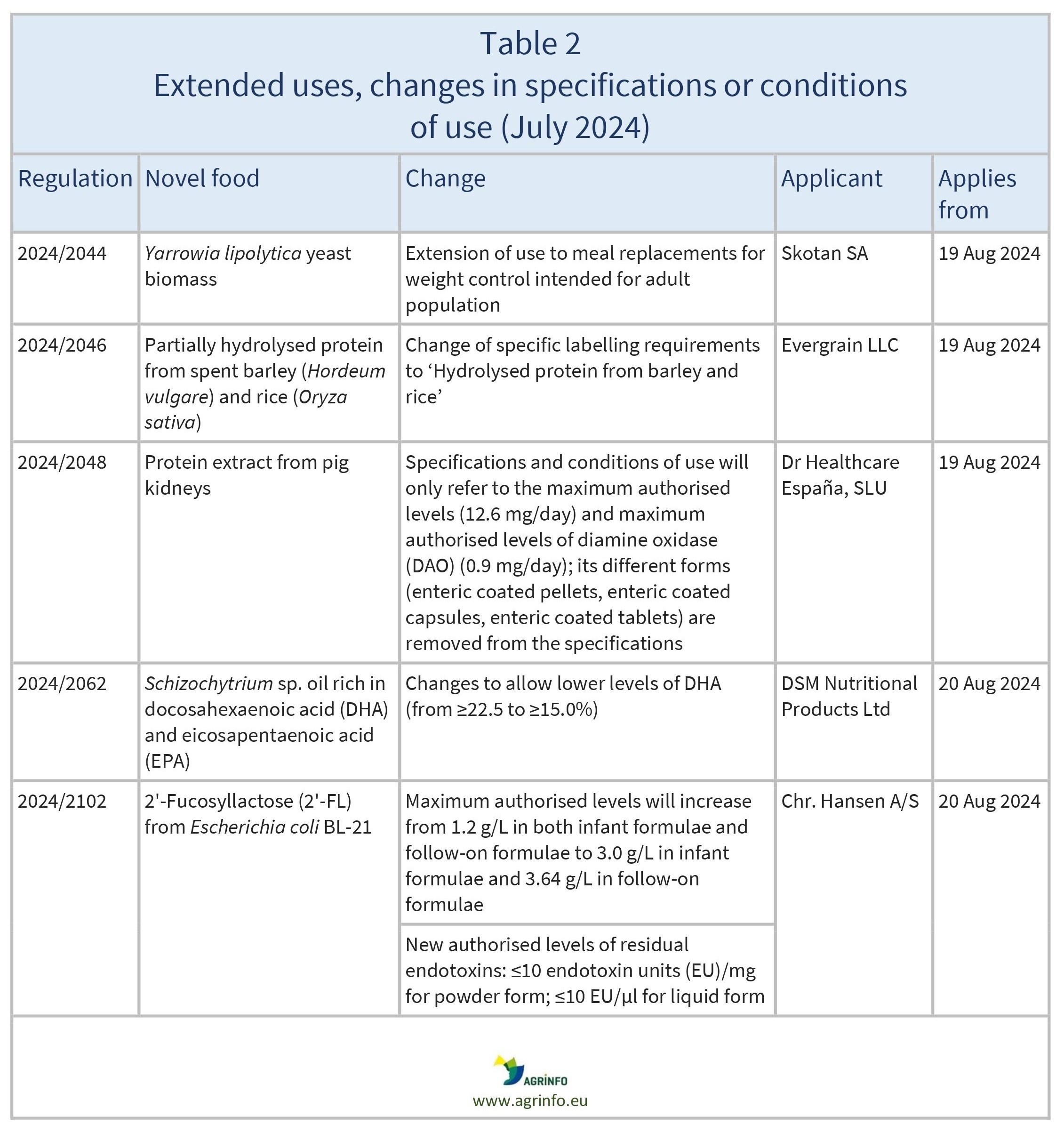
Autorizações de novos alimentos, utilizações alteradas e extensões adoptadas de janeiro a julho de 2024
Autorizações
Regulamentos de execução da Comissão 2024/2036, 2024/2049, 2024/2061, 2024/2090, 2024/2101
Alterações
Regulamentos de Execução da Comissão 2024/2044, 2024/2046, 2024/2048, 2024/2062, 2024/2102
Atualização
Este relatório resume as recentes decisões da UE para autorizar, alterar ou alargar as especificações ou condições de utilização de novos alimentos existentes:
- 2'-FL obtido por fermentação microbiana utilizando uma estirpe derivada de Escherichia coli pela Kyowa Hakko Bio Co.
- Mistura LNFP-I/2'-FL obtida por fermentação microbiana utilizando uma estirpe derivada de E. coli
- Óleo deSchizochytrium limacinum (TKD-1)
- Óleode Schizochytrium sp. (CABIO-A-2)
- Sumo do caule de Ashitaba.
A UE autorizou as seguintes alterações
- alargamento da utilização do novo alimento Yarrowia lipolytica yeast biomass aos substitutos de refeição para controlo do peso destinados à população adulta
- requisitos de rotulagem "Proteína parcialmente hidrolisada de cevada e arroz" para alimentos que contenham proteína parcialmente hidrolisada de cevada e arroz usados
- as especificações e condições de utilização do extrato proteico de rim de suíno apenas referem os teores máximos autorizados; as suas diferentes formas são eliminadas das especificações
- teores mais baixos de ácido docosa-hexaenóico (DHA) nas especificações do novo alimento Schizochytrium sp. óleo rico em DHA e ácido eicosapentaenóico (EPA)
- os níveis autorizados de 2'-FL aumentarão em relação aos níveis actuais autorizados tanto nas fórmulas para lactentes como nas fórmulas de transição
- os níveis autorizados de endotoxinas residuais para o 2'-FL produzido a partir da estirpe derivada E. coli BL-21 serão alinhados com os níveis já autorizados nas mesmas condições de utilização para o 2'-FL de E. coli K-12 e outros oligossacáridos do leite com níveis residuais semelhantes em fórmulas para lactentes e fórmulas de transição.
Produtos afetados
Produtos lácteos (pasteurizados, esterilizados, UHT), produtos à base de leite fermentado, bebidas aromatizadas, barras de cereais, fórmulas para lactentes, fórmulas de transição, alimentos transformados à base de cereais e alimentos para bebés, alimentos de substituição da dieta (para controlo do peso), alimentos medicinais especiais, suplementos alimentares
o que está a mudar?
A Comissão Europeia autorizou a colocação no mercado da UE dos novos alimentos enumerados no quadro 1. Estes alimentos serão incluídos na lista da União de novos alimentos (Regulamento 2017/2470). Para determinados novos alimentos, apenas as empresas requerentes a quem foi concedida a autorização estão autorizadas a vendê-los no mercado da UE durante os próximos 5 anos, exceto se permitirem que outras empresas os vendam, ou se outra empresa obtiver uma autorização para novos alimentos sem referência aos dados científicos protegidos utilizados pelo requerente original (ver nota de rodapé do quadro 1).
A Comissão também autorizou algumas alterações às especificações e condições de utilização de determinados novos alimentos que já estão autorizados e disponíveis no mercado da UE (ver quadro 2).
porquê?
Apenas os novos alimentos autorizados e incluídos na lista da União de novos alimentos podem ser colocados no mercado da UE (Regulamento 2015/2283).
A Autoridade Europeia para a Segurança dos Alimentos (EFSA) avalia os pedidos de novos alimentos para garantir a sua segurança nas condições e/ou níveis de utilização propostos [ver Recursos 1-6].
Cronologia
Os novos alimentos recentemente autorizados podem ser colocados no mercado da UE a partir da data indicada no quadro 1.
As alterações às especificações e condições aplicam-se a partir das datas indicadas no quadro 2.
Contexto legal
Para mais informações sobre o processo de autorização de novos alimentos, ver Novel foods explained.
Recursos
Comissão Europeia: Lista da União de novos alimentos
Regulamento (UE) 2017/2470 (lista da União de novos alimentos)
Regulamento (UE) 2015/2283 relativo a novos alimentos
Regulamento n.º 1169/2011 relativo à prestação de informação aos consumidores sobre os géneros alimentícios
Pareceres publicados pela Autoridade Europeia para a Segurança dos Alimentos (EFSA) sobre a segurança/eficácia dos seguintes novos alimentos:
- EFSA (2023) Safety of 2′-fucosyllactose (2′-FL) produced by a derivative strain (Escherichia coli SGR5) of E. coli W (ATCC 9637) as a Novel Food pursuant to Regulation (EU) 2015/2283 [Segurança da 2′-fucosilactose (2′-FL) produzida por uma estirpe derivada (Escherichia coli SGR5) de E. coli W (ATCC 9637) como novo alimento nos termos do Regulamento (UE) 2015/2283]. EFSA Journal, 21(11): 8333.
- EFSA (2023) Segurança da extensão da utilização de 2′-fucosilactose (2′-FL) como novo alimento nos termos do Regulamento (UE) 2015/2283. Jornal da EFSA, 21(11): e8334.
- EFSA (2023) Segurança de uma extensão da utilização de biomassa de levedura Yarrowia lipolytica como novo alimento nos termos do Regulamento (UE) 2015/2283. EFSA Journal, 21(11): e8416.
- EFSA (2023) Safety of lacto-N-fucopentaose I/2'-fucosyllactose (LNFP-I/2'-FL) mixture as a novel food pursuant to Regulation (EU) 2015/2283 [Segurança da mistura de lacto-N-fucopentaose I/2'-fucosilactose (LNFP-I/2'-FL) como novo alimento nos termos do Regulamento (UE) 2015/2283]. EFSA Journal, 21(12): e8412.
- EFSA (2023) Safety of oil from Schizochytrium limacinum (strain TKD-1) for use in infant and follow-on formula as a novel food pursuant to Regulation (EU) 2015/2283 [Segurança do óleo de Schizochytrium limacinum (estirpe TKD-1) para utilização em fórmulas para lactentes e fórmulas de transição como novo alimento nos termos do Regulamento (UE) 2015/2283]. EFSA Journal, 21(12): e8414.
- EFSA (2023) Safety of oil from Schizochytrium sp. (strain CABIO-A-2) for use in infant and follow-on formula as a novel food pursuant to Regulation (EU) 2015/2283 [Segurança do óleo de Schizochytrium sp. (estirpe CABIO-A-2) para utilização em fórmulas para lactentes e fórmulas de transição como novo alimento nos termos do Regulamento (UE) 2015/2283]. EFSA Journal, 21(12): e8415.
Fontes
Regulamento de Execução da Comissão:
2024/2036 que autoriza a colocação no mercado de 2'-Fucosilactose produzida por uma estirpe derivada de Escherichia coli W (ATCC 9637) como novo alimento
2024/2044 no que diz respeito às especificações e às condições de utilização do novo alimento biomassa de levedura Yarrowia lipolytica
2024/2046 no que se refere aos requisitos específicos de rotulagem do novo alimento proteína parcialmente hidrolisada de cevada(Hordeum vulgare) e arroz(Oryza sativa) usados
2024/2048 no que se refere às especificações e às condições de utilização do novo alimento extrato proteico de rins de suíno
2024/2049 que autoriza a colocação no mercado de óleo de Schizochytrium limacinum (TKD-1) como novo alimento
2024/2061 que autoriza a colocação no mercado do sumo dos caules da planta Angelica keiskei (sumo dos caules de Ashitaba) como novo alimento
2024/2062 no que diz respeito às especificações do novo alimento óleo de Schizochytrium sp. rico em DHA e EPA
2024/2090 que autoriza a colocação no mercado da mistura de Lacto-N-fucopentaose I e 2'-Fucosilactose produzida utilizando uma estirpe derivada de Escherichia coli K-12 DH1 como novo alimento
2024/2101 que autoriza a colocação no mercado de óleo de Schizochytrium sp. (CABIO-A-2) como novo alimento
2024/2102 no que diz respeito às condições de utilização do novo alimento 2'-Fucosilactose e no que diz respeito às especificações do novo alimento 2'-Fucosilactose produzido com uma estirpe derivada de Escherichia coli BL-21
Isenção de responsabilidade: Em nenhuma circunstância a COLEAD será responsável por quaisquer perdas, danos, responsabilidades ou despesas incorridas ou sofridas que sejam alegadamente resultantes da utilização das informações disponíveis neste sítio Web ou de qualquer ligação a sítios externos. A utilização do sítio Web é da exclusiva responsabilidade e risco do utilizador. Esta plataforma de informação foi criada e é mantida com o apoio financeiro da União Europeia. No entanto, o seu conteúdo não reflete as opiniões da União Europeia.
Autorizações de novos alimentos, utilizações alteradas e extensões adoptadas de janeiro a julho de 2024
Authorisations
Commission Implementing Regulations 2024/2036, 2024/2049, 2024/2061, 2024/2090, 2024/2101
Amendments
Commission Implementing Regulations 2024/2044, 2024/2046, 2024/2048, 2024/2062, 2024/2102
o que está a mudar e porquê?
A Comissão Europeia autorizou a colocação no mercado da UE dos novos alimentos enumerados no quadro 1.
A Comissão também autorizou algumas alterações às especificações e condições de utilização de determinados novos alimentos que já estão autorizados e disponíveis no mercado da UE (ver Quadro 2).
Cronologia
Os novos alimentos recentemente autorizados podem ser colocados no mercado da UE a partir da data indicada no quadro 1.
As alterações às especificações e condições aplicam-se a partir das datas indicadas no quadro 2.
Quadros e figuras
Isenção de responsabilidade: Em nenhuma circunstância a COLEAD será responsável por quaisquer perdas, danos, responsabilidades ou despesas incorridas ou sofridas que sejam alegadamente resultantes da utilização das informações disponíveis neste sítio Web ou de qualquer ligação a sítios externos. A utilização do sítio Web é da exclusiva responsabilidade e risco do utilizador. Esta plataforma de informação foi criada e é mantida com o apoio financeiro da União Europeia. No entanto, o seu conteúdo não reflete as opiniões da União Europeia.